
| A. | 1mol•L-1 Na2CO3溶液中,含CO${\;}_{3}^{2-}$數目小于NA | |
| B. | 1mol FeCl3完全轉化為氫氧化鐵膠體后,其中膠體粒子數目為NA | |
| C. | 25℃時,1L pH=12的Ba(OH)2溶液中含有的OH-數目為0.02NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃燒時消耗O2的分子數為7.5NA |
分析 A、溶液體積不明確;
B、一個氫氧化鐵膠粒是多個氫氧化鐵的聚集體;
C、pH=12的氫氧化鋇溶液中,氫氧根的濃度為0.01mol/L;
D、1mol苯和1mol苯甲酸燃燒時均消耗7.5mol氧氣.
解答 解:A、溶液體積不明確,故溶液中的碳酸根的個數無法計算,故A錯誤;
B、一個氫氧化鐵膠粒是多個氫氧化鐵的聚集體,故1mol氯化鐵形成的氫氧化鐵膠粒的個數小于NA個,故B錯誤;
C、pH=12的氫氧化鋇溶液中,氫氧根的濃度為0.01mol/L,故1L的該溶液中的氫氧根的個數為0.01NA個,故C錯誤;
D、1mol苯和1mol苯甲酸燃燒時均消耗7.5mol氧氣,故1mol苯和苯甲酸的混合物燃燒消耗7.5mol氧氣,即7.5NA個氧氣分子,與兩者的比例無關,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,掌握物質的量的計算公式和物質結構是解題關鍵,難度不大.


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 甲醛 | B. | 乙醛 | C. | 丁醛 | D. | 戊醛 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗方案 | 實驗目的 |
| A | 金屬甲、乙在氫氧化鈉溶液中構成原電池 | 驗證甲、乙的活性強弱 |
| B | 用惰性電極電解不同濃度的AgNO3和Cu(NO3)2的混合溶液 | 證明單質銅比銀活潑 |
| C | 在氫氧化鎂和氫氧化鈉溶液中加入氯化鐵溶液 | 證明Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| D | 測定0.1mol•L-1Na2X、0.1mol•L-1Na2Y溶液的pH | 驗證H2X和H2Y酸性的相對強弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 步驟1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,靜置. | 出現白色沉淀. |
| 步驟2:取1mL上層清液于試管中,滴加1滴2mol•L-1Fe(NO3)3溶液. | 溶液變為紅色. |
| 步驟3:向步驟2的溶液中,繼續加入5滴 3mol•L-1AgNO3溶液. | 現象a出現白色沉淀,溶液紅色變淺. |
| 步驟4:向步驟1余下的濁液中加入5滴 3mol•L-1KI溶液. | 出現黃色沉淀. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
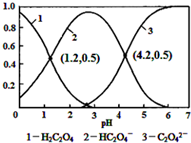
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 將相同物質的量KHC2O4和K2C2O4固體完全溶于水所得混合液的pH為4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液將pH增大至4.2的過程中水的電離度一定增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com