
| 物質 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
| 物質 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 開始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
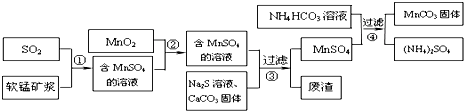
分析 軟錳礦主要成分為MnO2,其中含有鐵、鋁、硅的氧化物和少量重金屬化合物雜質,用軟錳礦與來自工業廢氣主要是SO2反應生成硫酸錳,另外還原硫酸鐵、硫酸亞鐵等,再加入二氧化錳反應使亞鐵離子被氧化成鐵離子,得到含有硫酸錳的溶液中再加入硫化鈉和碳酸鈣固體,反應后過濾得硫酸錳溶液,在硫酸錳溶液中加入碳酸氫鈉得碳酸錳沉淀和硫酸銨溶液,過濾得碳酸錳固體,
(1)軟錳礦漿是二氧化錳,MnSO4溶液水解顯酸性,Fe3+將SO2氧化為硫酸;
(2)MnO2可將Fe2+氧化成Fe3+,Fe3+完全沉淀的pH較Fe2+低;
(3)碳酸鈣與溶液中的H+反應,使溶液中的PH升高;
(4)加入一種反應物能提高另一種反應物的裝化率;MnCO3,NH4HCO3與酸反應;
(5)錳礦與煤炭粉混合,焙燒生成二氧化硫,污染空氣.
解答 解:(1)軟錳礦漿是二氧化錳,MnSO4溶液水解先酸性,根據2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.Fe3+可將SO2氧化為硫酸,故答案為:小;工業制備硫酸;
(2)MnO2可將Fe2+氧化成Fe3+,反應的離子方程式為MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,Fe3+完全沉淀的pH較Fe2+低,所以將溶液中的Fe2+氧化成Fe3+,
故答案為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe2+ 轉變為Fe3+,Fe3+完全沉淀的pH較低(或Fe3+更易沉淀);
(3)碳酸鈣與溶液中的H+反應,使溶液中的PH升高,使溶液中的Fe3+、Al3+轉化為氫氧化物沉淀,
故答案為:與溶液中的酸反應,使溶液中的Fe3+、Al3+轉化為氫氧化物沉淀;
(4)加入稍過量的NH4HCO3能提高MnSO4的裝化率,使MnCO3沉淀完全,溶液的pH不過低,H+可與MnCO3,NH4HCO3反應,
故答案為:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3與酸反應(或MnCO3、NH4HCO3與酸反應溶解);
(5)錳礦與煤炭粉混合,焙燒生成二氧化硫,污染空氣,而工藝A不僅不產生二氧化硫,且能生產硫酸,故答案為:節約能源、治理含SO2的工業廢氣等.
點評 本題考查了流程分析,反應過程理解應用,反應現象和產物的判斷,注意基本實驗的操作步驟,離子方程式書寫等,題目難度中等.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y的能量一定高于N | |
| B. | X、Y的能量總和高于M、N的能量總和 | |
| C. | 因為該反應為放熱反應,故不必加熱就可發生 | |
| D. | 斷裂X、Y的化學鍵所吸收的能量高于形成M、N的化學鍵所放出的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HF電離:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 水解消耗0.1mol F-時,吸收的熱量為6.77kJ | |
| C. | 中和熱均為57.3 kJ/mol | |
| D. | 含0.1mol HF、0.1mol NaOH 的兩種溶液混合后放出的熱量為6.77kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質在酶的作用下水解的最終產物為氨基酸 | |
| B. | 向蛋白質溶液加入(NH4)2SO4濃溶液,會使其變性 | |
| C. | 天然蛋白質僅由碳、氫、氧、氮四種元素組成 | |
| D. | 氨基酸和蛋白質都是只能和堿反應的酸性物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com