
【題目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作電極電解此溶液,當通電一段時間后,兩極都收集到22.4L氣體(標準狀況),假設電解后溶液的體積仍為500mL.下列說法正確的是( )
A.原混合溶液中K+的物質的量濃度為1 mol/L
B.上述電解過程中共轉移4mol電子
C.電解得到的Cu的物質的量為0.5mol
D.電解后溶液中H+的物質的量濃度為2mol/L
【答案】B
【解析】解:兩極都收集到22.4L氣體(標準狀況),氣體物質的量為1mol,
陽極反應為:
4OH﹣﹣ | 4e﹣=2H2O+ | O2↑ |
4mol | 4mol | 1mol |
電解過程中電子轉移總數為4mol,兩電極電子轉移相同;
陰極反應為:
Cu2++ | 2e﹣= | Cu; | 2H++ | 2e﹣= | H2↑ |
1mo | 2mol | 1mo | 2mol | 2mol | 1mo |
根據500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L,C(Cu2+)= ![]() =2mol/L,溶液中存在電荷守恒為:[K+]+2[Cu2+]=[NO3﹣],計算[K+]=2mol/L;
=2mol/L,溶液中存在電荷守恒為:[K+]+2[Cu2+]=[NO3﹣],計算[K+]=2mol/L;
A、計算可知原混合溶液中K+的物質的量濃度為2 mol/L,故A錯誤;
B、上述電解過程中共轉移4mol電子,故B正確;
C、電解得到的Cu的物質的量為1mol,故C錯誤;
D、電解后溶液中H+的物質的量濃度是氫氧根離子減少的量減去氫離子減少量,濃度= ![]() =4mol/L,故D錯誤;
=4mol/L,故D錯誤;
故選B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】2SO2(g)十O2(g)=2SO3(g) △H =-198kJ·mol-1,在V2O3存在時,該反應機理為:V2O3+ SO2-→+2VO3+ SO3(快) 4VO2+O2→2 V2O3(慢)。下列說法正確的是
A. 反應速率主要取決于V2O3的質量 B. VO2是該反應的催化劑
C. 該反應逆反應的活化能大于198kJ/mol D. 升高溫度,該反應的△H增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯原子的結構示意圖為_____________________。
(2)![]() 微粒中的質子數是_______,中子數是_______,核外電子數是_______。
微粒中的質子數是_______,中子數是_______,核外電子數是_______。
(3)49g 硫酸的物質的量為________mol,其完全電離產生H+的個數為___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,則溶液中Al3+的物質的量濃度_________;SO42 物質的量濃度__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據原子結構及元素周期律的知識,下列推斷正確的是
A. ![]() 與
與![]() 得電子能力相同
得電子能力相同
B. 核外電子排布相同的微粒化學性質也相同
C. Cl-、 S2-、 Ca2+、 K+半徑逐漸減小
D. 同主族元素含氧酸的酸性隨核電荷數的增加而減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣中含有CO、NO2等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣體.
(1)4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=﹣1 200kJmol﹣1
對于該反應,溫度不同(T2>T1)、其他條件相同時,下列圖象正確的是(填代號).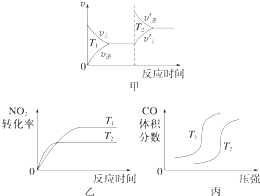
(2)汽車尾氣中CO與H2O(g)在一定條件下可以發生反應:
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.
820℃時在甲、乙、丙三個恒容密閉容器中,起始時按照下表進行投料,達到平衡狀態,K=1.0.
起始物質的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①該反應的平衡常數表達式為 .
②平衡時,甲容器中CO的轉化率是 . 比較下列容器中CO的轉化率:乙甲;丙甲(填“>”、“=”或“<”).
③丙容器中,通過改變溫度,使CO的平衡轉化率增大,則溫度(填“升高”或“降低”),平衡常數K(填“增大”、“減小”或“不變”).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com