
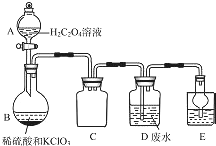
 ClO2是一種國際上公認的安全無毒的綠色水處理劑.回答下列問題:
ClO2是一種國際上公認的安全無毒的綠色水處理劑.回答下列問題:分析 (1)①熟悉儀器的形狀說出其名稱;依據C裝置進氣管、出氣管都較短可知為安全瓶,防止倒吸;
②稀硫酸、KClO3和草酸溶液制備ClO2,發生氧化還原反應,草酸被氧化為二氧化碳,氯酸鉀被還原為ClO2,結合原子守恒、電子守恒配平書寫化學方程式;
③二氧化氯具有強的氧化性,能夠氧化二價錳離子生成二氧化錳,本身被還原為氯離子;
(2)①加入的指示劑為淀粉,淀粉遇單質碘變藍,則單質碘反應完,則溶液顏色由藍色變為無色,達到滴定終點;
②根據關系式2ClO2~5I2~10Na2S2O3計算c(ClO2);
③根據實驗操作中滴定液體積大小的影響來回答判斷.
解答 解;(1)①A裝置的名稱是分液漏斗;依據C裝置進氣管、出氣管都較短可知為安全瓶,防止倒吸;
故答案為:分液漏斗; 防倒吸;
②用H2C204溶液、稀硫酸和KC103制備ClO2反應產物為二氧化氯、二氧化碳可稀釋Cl02,草酸被氧化為二氧化碳,氯酸鉀被還原為ClO2,反應的化學方程式為:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2↑+2ClO2↑+2H2O,
故答案為:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2↑+2ClO2↑+2H2O;
③二氧化氯具有強的氧化性,能夠氧化二價錳離子生成二氧化錳,本身被還原為氯離子,離子方程式:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
故答案為:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
(2)①加入的指示劑為淀粉,淀粉遇單質碘變藍,則單質碘反應完,則溶液顏色由藍色變為無色,半分鐘不變化說明反應達到滴定終點,
故答案為:加到最后一滴時,溶液的顏色恰好由藍色變為無色,且半分鐘不變化;
②設原ClO2溶液的濃度為x,準確量取ClO2溶液10.00mL,稀釋成100.00mL試樣,則濃度變為$\frac{x}{10}$,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{x}{10}$V1×10-3mol 1×10-3cV2mol
x=$\frac{2mol×1×1{0}^{-3}c{V}_{2}mol}{10mol×\frac{1}{10}{V}_{1\\;}×1{0}^{-3}mol}$=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=67.5g/mol×$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g•L-1,
故答案為:$\frac{135c{V}_{2}}{{V}_{1}}$;
③若實驗中使用的Na2S2O3標準溶液部分因被氧氣氧化而變質,則相當于消耗的滴定液的體積偏大,所以測定結果偏大,
故答案為:偏高.
點評 本題考查實驗方案的設計,同時考查學生分析問題、解決問題的能力,明確物質的性質是解本題關鍵,題目難度中等.計算時要注意二氧化氯濃度的變化.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
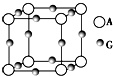 已知:A、B、C、D、E、F、G七種元素的核電荷數依次增大,屬于元素周期表中前四周期的元素.其中A原子在基態時p軌道半充滿且電負性是同族元素中最大的;D、E原子核外的M層中均有兩個未成對電子;G原子核外價電子數與B相同,其余各層均充滿.B、E兩元素組成化合物B2E的晶體為離子晶體.C、F的原子均有三個能層,C原子的第一至第四電離能(KJ•mol-1)分別為578、1 817、2 745、11 575;C與F能形成原子數目比為1:3、熔點為190℃的化合物Q.
已知:A、B、C、D、E、F、G七種元素的核電荷數依次增大,屬于元素周期表中前四周期的元素.其中A原子在基態時p軌道半充滿且電負性是同族元素中最大的;D、E原子核外的M層中均有兩個未成對電子;G原子核外價電子數與B相同,其余各層均充滿.B、E兩元素組成化合物B2E的晶體為離子晶體.C、F的原子均有三個能層,C原子的第一至第四電離能(KJ•mol-1)分別為578、1 817、2 745、11 575;C與F能形成原子數目比為1:3、熔點為190℃的化合物Q.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
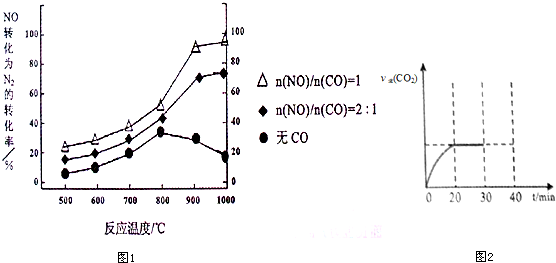
| 濃度/mol?L-1 時間/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
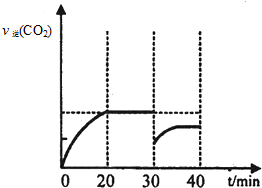 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述反應中金屬共失去電子0.1 mol | |
| B. | 合金中,銅的質量為2.8 g | |
| C. | 原硝酸的濃度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金屬離子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 澄清的石灰水與稀鹽酸反應 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 鈉與水的反應 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 銅片插入硝酸銀溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液與Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com