
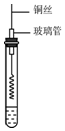
 乙醇是一種重要的有機化工原料,它可以用玉米、薯類等為原料發酵、蒸餾制成.乙醇和汽油經加工處理形成的車用燃料即乙醇汽油.
乙醇是一種重要的有機化工原料,它可以用玉米、薯類等為原料發酵、蒸餾制成.乙醇和汽油經加工處理形成的車用燃料即乙醇汽油.分析 (1)醇的官能團為羥基;
(2)乙醇能與黑色的氧化銅反應得到乙醛和紅色的銅以及水;
(3)乙醇優點很多,如:環保、節省能源、新的清潔型能源等,燃燒生成二氧化碳和水;
(4)根據反應物及化合價的變化判斷;
(5)乙烯含有碳碳雙鍵,與水發生加成反應生成乙醇.
解答 解:(1)乙醇分子中的官能團名稱為羥基,故答案為:-OH(或羥基);
(2)金屬銅在乙醇氧化生成乙醛的反應中作催化劑,螺旋狀的銅絲放在酒精燈外焰部分加熱,銅被氧氣氧化為黑色氧化銅,氧化銅能將乙醇氧化為乙醛,自身被還原成銅,乙醇與氧氣催化氧化的化學反應方程式2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案為:變紅;2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)乙醇完全燃燒產物為二氧化碳和水,對環境無污染,屬于可再生能源,使用乙醇汽油節可約化石燃料,乙醇與氧氣在點燃的條件下反應生成水和二氧化碳,其化學方程式為:C2H5OH+3O2$\stackrel{點燃}{→}$2CO2+3H2O,
故答案為:節約化石燃料,減少污染;C2H5OH+3O2$\stackrel{點燃}{→}$2CO2+3H2O;
(4)由題意知,被檢測的物質是乙醇;該反應2CrO3 (紅色)+3C2H5OH+3H2SO4=Cr2(SO4)3(綠色)+3CH3CHO+6H2O中,
元素的化合價變化如下:CrO3→Cr2(SO4)3,Cr元素由+6價→+3價,得電子化合價降低,CrO3是氧化劑;
C2H5OH→CH3CHO,C元素由-2價→-1價,失電子化合價升高,乙醇是還原劑,
故答案為:C2H5OH;CrO3;C2H5OH;
(5)CH2=CH2中含有不飽和的C=C雙鍵,能夠在催化劑存在條件下與水發生加成反應生成乙醇,反應的化學方程式為:CH2=CH2+H2O$\stackrel{催化劑}{→}$CH3CH2OH,
故答案為:CH2=CH2+H2O$\stackrel{催化劑}{→}$CH3CH2OH;加成反應.
點評 本題考查綜合乙醇的性質,為高頻考點,側重考查學生的分析能力和實驗能力,題目難度不大,注意掌握常見有機物結構與性質,根據反應原理找出正確的反應物、生成物、反應條件為解答關鍵.


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:多選題
| A. | 鋁粉投入到NaOH溶液中:2Al+6H2O+2OH-═2 Al(OH)4-+H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═Al(OH)4- | |
| C. | NaAl(OH)4溶液中通入足量的CO2:2 Al(OH)4-+CO2═2Al(OH)3↓+CO32-+H2O | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2 Al(OH)4-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅片、鐵片、FeCl3溶液組成的原電池 | |
| B. | 石墨、鐵片、FeCl3溶液組成的原電池 | |
| C. | 鎂片、鋅片、Fe2(SO4)3溶液組成的原電池 | |
| D. | 銀片、鐵片、Fe(NO3)3溶液組成的原電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚乙烯塑料的老化是因為發生了加成反應 | |
| B. | 聚乙烯塑料制品可用于食品的包裝 | |
| C. | 乙烯和乙烷都能發生加聚反應 | |
| D. | 乙烯分子中所有原子不可能在同一平面內 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某化學興趣小組為探究元素性質的遞變規律,設計了如下系列實驗.
某化學興趣小組為探究元素性質的遞變規律,設計了如下系列實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl的電子式 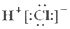 | B. | Cl-的結構示意圖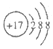 | ||
| C. | CO2的電子式 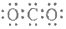 | D. | 質量數為37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗操作 | |
| A | 制備Fe(OH)3膠體 | 將NaOH濃溶液滴加到飽和FeCl3溶液中 |
| B | 配制氯化鐵溶液 | 將氯化鐵溶解在較濃的鹽酸中再加水稀釋 |
| C | 確定Na2SO3樣品是否部分被氧化 | 取樣于試管中,加入稀硝酸酸化,再滴加BaCl2溶液,觀察是否有白色沉淀生成 |
| D | 檢驗乙醇發生消去反應生成 乙烯 | 將生成的氣體直接通入盛有酸性高錳酸鉀溶液的試劑瓶,觀察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com