
【題目】將一定量的X加入某密閉容器中,發生反應:2X(g)![]() 3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷正確的是()。
3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷正確的是()。
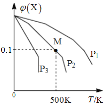
A. 升高溫度,該反應平衡常數K減小
B. 壓強大小有P3>P2>P1
C. 平衡后加入高效催化劑使平均摩爾質量增大
D. 在該條件下M點X平衡轉化率為9/11
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】有機物Z是制備藥物的中間體,合成Z的路線如下圖所示:
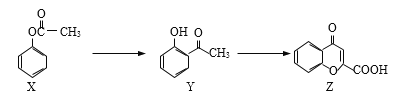
下列有關敘述正確的是
A. 三種物質中都含有羰基
B. 等物質的量的Y、Z能和含有等物質的量的NaOH的溶液反應
C. 可用NaHCO3溶液鑒別三種物質
D. 1 mol Z跟足量O2反應,最多消耗10 mol O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列說法正確的是( )
A.標準狀況下,將2.24L Cl2溶于水,可得到HClO分子的數目小于0.1NA
B.2.3gNa與氧氣完全反應,反應中轉移的電子數介于0.1NA到0.2NA之間
C.1L 0.1 mol/L醋酸溶液中含有的氫離子數為0.1NA
D.常溫常壓下,7.0g乙烯與丙烯的混合物中含有的電子數目為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是元素周期表誕生150周年,元素周期表(律)在學習、研究和生產實踐中有很重要的作用。下表為元素周期表的一部分,回答下列問題。
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金屬性最強的是________(填元素符號。
(2)中國青年化學家姜雪峰被國際組織推選為“元素⑦代言人”,元素⑦的原子結構示意圖是_________,其氫化物的電子式是_________。
(3)比較元素②、③的最高價氧化物對應水化物的酸性:______>______(填化學式)。說明你判斷的理由:_________。
(4)主族元素砷(As)的部分信息如圖所示。

①砷(As)在周期表中的位置是______。
②下列說法正確的是_______(填序號)。
a.砷元素的最高化合價為+4
b.推測砷有多種氧化物
c.③的氣態氫化物的還原性大于砷的氣態氫化物的還原性
(5)某小組同學設計實驗比較VIIA元素的非金屬性:Cl>Br>I。已知:常溫下濃鹽酸與高錳酸鉀反應生成氯氣。
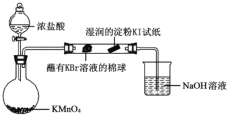
打開分液漏斗的活塞,燒瓶中產生黃綠色氣體,蘸有KBr溶液的棉球變為橙紅色,濕潤的淀粉KI試紙變藍,據此現象能否說明非金屬性:Br >I,并說明理由_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素,離子方程式為2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化),實驗裝置如圖甲所示:

實驗序號 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)該實驗探究的是_________________________________因素對化學反應速率的影響。
(2)若實驗①在2 min末收集了4.48 mL CO2(標準狀況下),則在2 min末,c(MnO4-)=________ mol·L-1(假設混合溶液的體積為50 mL)。
(3)小組同學發現反應速率變化如圖乙,其中t1~t2時間內速率變快的主要原因可能是:
①產物Mn2+是反應的催化劑,②_______________________________
Ⅱ:當溫度高于500 K時,科學家成功利用二氧化碳和氫氣合成了乙醇,這在節能減排、降低碳排放方面具有重大意義。回答下列問題:
(1)該反應的化學方程式為___________________________________
(2)在恒溫恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________________
a.體系壓強不再改變 b.H2的濃度不再改變
c.氣體的密度不隨時間改變 d.單位時間內消耗H2和CO2的物質的量之比為3∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗過程可以達到實驗目的的是
選項 | 實驗目的 | 實驗過程 |
A | 制備Fe(OH)膠體 | 將NaOH濃溶液滴加到飽和FeCl溶液中 |
B | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,過濾、洗滌、干燥 |
C | 探究維生素C的還原性 | 向盛有2 mL黃色氯化鐵溶液的試管中滴加濃的維生素C溶液,觀察顏色變化 |
D | 配制0.4000mol·L的NaOH溶液250mL | 稱取4.0 g固體NaOH于燒杯中,加入少量蒸餾水溶解,立刻轉移至250 mL容量瓶中定容 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取 1LFeCl3 溶液腐蝕銅板制作電路板,反應后在此殘留液中慢慢加入鐵粉,溶液中 Fe2+的濃度變化如圖所示(加入固體引起的體積變化忽略不計),下列說法錯誤的是
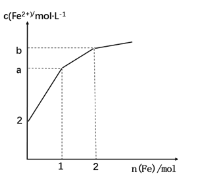
A.當n(Fe)=0.5mol 時,發生的離子反應為 Fe+2Fe3+=3Fe2+
B.當 n(Fe)=1.5mol 時,溶液中發生的總反應離子方程式為4Fe3++Cu2++3Fe=7Fe2++Cu
C.當n(Fe)=1mol 時,溶液中 c(Fe2+)=5 mol·L-1
D.腐蝕之前原溶液中n(Fe3+)=4 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛、二氧化鉛、氟硼酸(HBF4)電池是一種低溫性能優良的電池,常用于軍事和國防工業,其總反應方程式為Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的強電解質],下列說法中不正確的是( )
2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的強電解質],下列說法中不正確的是( )
A. 放電時,溶液中的BF4-向負極移動
B. 放電時,轉移1mol電子時正極減少的質量為119.5g
C. 充電時,陽極附近溶液的酸性減弱
D. 充電時,陰極的電極反應式為Pb2++2e-═Pb
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com