
【題目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素,離子方程式為2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化),實驗裝置如圖甲所示:

實驗序號 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)該實驗探究的是_________________________________因素對化學反應速率的影響。
(2)若實驗①在2 min末收集了4.48 mL CO2(標準狀況下),則在2 min末,c(MnO4-)=________ mol·L-1(假設混合溶液的體積為50 mL)。
(3)小組同學發現反應速率變化如圖乙,其中t1~t2時間內速率變快的主要原因可能是:
①產物Mn2+是反應的催化劑,②_______________________________
Ⅱ:當溫度高于500 K時,科學家成功利用二氧化碳和氫氣合成了乙醇,這在節能減排、降低碳排放方面具有重大意義。回答下列問題:
(1)該反應的化學方程式為___________________________________
(2)在恒溫恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________________
a.體系壓強不再改變 b.H2的濃度不再改變
c.氣體的密度不隨時間改變 d.單位時間內消耗H2和CO2的物質的量之比為3∶1
【答案】濃度0.0052反應放熱,溫度升高2CO2+6H2![]() C2H5OH(g)+3H2O(g)ab
C2H5OH(g)+3H2O(g)ab
【解析】
Ⅰ:(1)對比①②實驗可知,探究的是濃度對化學反應速率的影響,故答案為:濃度;
(2)CO2的物質的量是:4.48mL×10-322.4mol/l=0.0002mol,設2min末,反應的MnO4-的物質的量為X,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0002mol
解得 X=0.00004mol,30mL×10-3×0.01molL-1-0.00004mol=0.00026mol,c(MnO4-)=nv=0.00026mol0.05L=0.0052mol/L,故答案為:0.0052;
(3)影響化學反應速率的因素主要有溫度、濃度、壓強和催化劑,除催化劑之外,只能是溫度升高導致反應速率加快,故答案為:該反應放熱使反應溫度升高;
Ⅱ:(1)當溫度高于500K時,科學家成功利用二氧化碳和氫氣合成了1mol乙醇和水,該反應的化學方程式為:2CO2+6H2CH3CH2OH(g)+3H2O(g),故答案為:2CO2+6H2CH3CH2OH(g)+3H2O(g);
(2)a.該反應中混合氣體的物質的量減小,則體系壓強一直在減小,當體系壓強不再改變,能說明到達平衡,故a正確;b.H2的濃度不再改變,說明正逆反應速率相等,該反應達到平衡狀態,故b正確;c.容器的體積不變,混合氣體的質量不變,混合氣體的密度始終不變,氣體的密度不隨時間改變,不能說明到達平衡,故c錯誤;d.單位時間內消耗H2和CO2的物質的量之比為3:1,指正反應方向,無法判斷正逆反應速率是否相等,則不能說明到達平衡,故d錯誤;故答案為:ab。


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】已知25℃時,K=![]() =1.75×10-5,其中K是該溫度下CH3COOH的電離平衡常數。下列說法正確的是( )
=1.75×10-5,其中K是該溫度下CH3COOH的電離平衡常數。下列說法正確的是( )
A.向該溶液中加入一定量的硫酸,K增大
B.升高溫度,K增大
C.向CH3COOH溶液中加入少量水,K增大
D.向CH3COOH溶液中加入少量氫氧化鈉溶液,K增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧元素為地殼中含量最高的元素,可形成多種重要的單質和化合物。
(1)氧元素位于元素周期表中___________區;第二周期元素中,第一電離能比氧大的有___________種。
(2)O3可用于消毒。O3的中心原子的雜化形式為___________;其分子的 VSEPR模型為___________,與其互為等電子體的離子為___________(寫出一種即可)。
(3)含氧有機物中,氧原子的成鍵方式不同會導致有機物性質不同。解釋C2H5OH的沸點高于CH3OCH3的原因為___________;C2H5OH不能用無水CaCl2千燥是因為Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,該離子的結構式可表示為______________________。
(4)氧元素可分別與Fe和Cu形成低價態氧化物FeO和Cu2O。

①FeO立方晶胞結構如圖1所示,則Fe2+的配位數為___________;與O2-緊鄰的所有Fe2+構成的幾何構型為___________。
②Cu2O立方晶胞結構如圖2所示,若O2-與Cu+之間最近距離為a pm,則該晶體的密度為___________g·cm-3。(用含a、NA的代數式表示,NA代表阿伏加德羅常數的值)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池已用于航天飛機,其工作原理如圖所示。關于該燃料電池的說法不正確的是
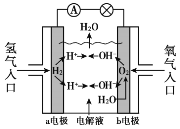
A. H2在負極發生氧化反應
B. 電子從a電極經外電路流向b電極
C. 供電時的總反應為:2H2 + O2 == 2H2O
D. 燃料電池的能量轉化率可達100%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究含碳化合物的結構與性質,對生產、科研等具有重要意義。
(1)某同學畫出基態碳原子的核外電子排布圖:![]() ,該電子排布圖違背了__;CH3+、-CH3、CH3-都是重要的有機反應中間體。CH3+、CH3-的空間構型分別為___、____。
,該電子排布圖違背了__;CH3+、-CH3、CH3-都是重要的有機反應中間體。CH3+、CH3-的空間構型分別為___、____。
(2)冠醚是由多個二元醇分子之間失水形成的環狀化合物。X、Y、Z是常見的三種冠醚,其結構如圖所示。它們能與堿金屬離子作用,并且隨著環的大小不同而與不同金屬離子作用。
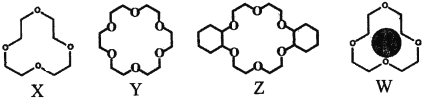
①Li+與X的空腔大小相近,恰好能進入到X的環內,且Li+與氧原子的一對孤電子對作用形成穩定結構W(如圖)。基態鋰離子核外能量最高的電子所處能層符號為___________;
②冠醚Y能與K+形成穩定結構,但不能與Li+形成穩定結構。理由是___________。
③烯烴難溶于水,被KMnO4水溶液氧化的效果較差。若烯烴中溶入冠醚Z,氧化效果明顯提升。
i.水分子中氧的雜化軌道的空間構型是___________,H-O鍵鍵角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z與KMnO4可以發生下圖所示的變化。加入冠醚Z后,烯烴的氧化效果明顯提升的原因是___________。
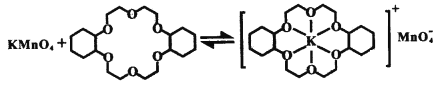
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是重要有機化工原料。結合以下路線回答:
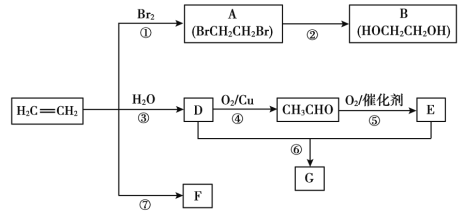
已知:2CH3CHO + O2催化劑,加熱2CH3COOH
(1)反應①的化學方程式是_______。
(2)B的官能團是_______。
(3)F是一種高分子,可用于制作食品袋,其結構簡式為_______。
(4)G是一種油狀、有香味的物質,有以下兩種制法。
制法一:實驗室用D和E反應制取G,裝置如圖所示。

i.反應⑥的化學方程式是______,反應類型是_____。
ii.分離出試管乙中油狀液體用到的主要儀器是_______。
制法二:工業上用CH2=CH2和E直接反應獲得G。
iii.反應類型是___。
iv.與制法一相比,制法二的優點是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物![]() 有多種同分異構體,其中屬于酯類且氯原子直接連接在苯環上的同分異構體有多少種(不考慮立體異構)
有多種同分異構體,其中屬于酯類且氯原子直接連接在苯環上的同分異構體有多少種(不考慮立體異構)
A.19種 B.9種 C.15種 D.6種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醛(HCHO)在化工、醫藥、農藥等方面有廣泛的應用。
(1)甲醇脫氫法可制備甲醛(反應體系中各物質均為氣態),結合下圖回答問題。
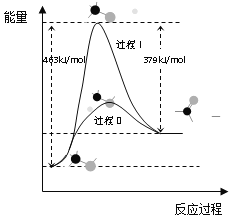
①此反應的熱化學方程式是______
②反應活化能:過程I___過程II(填“>”“=”或“<”)
③過程II溫度—轉化率圖如下,下列說法合理的是_____
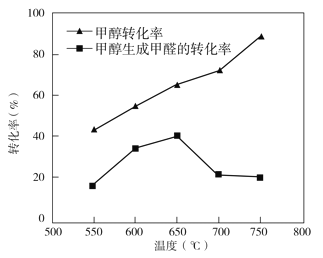
a.甲醇脫氫法制備甲醛過程無副反應發生
b.溫度高于 650℃催化劑燒結,活性減弱
c.及時分離產品有利于提高甲醇生成甲醛的轉化率
(2)甲醛超標會危害人體健康,需對甲醛進行含量檢測及污染處理。
①某甲醛氣體傳感器的工作原理如圖所示,b極的電極反應式為____,當電路中轉移4×10-4 mol電子時,傳感器內參加反應的甲醛(HCHO)為_____mg。

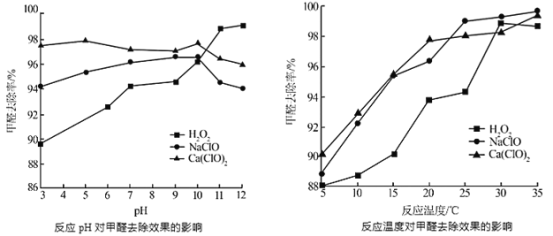
②氧化劑可處理甲醛污染,結合以下圖像分析春季(水溫約15℃)應急處理甲醛污染的水源應選擇的試劑為______
查看答案和解析>>
科目:高中化學 來源: 題型:
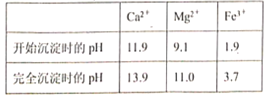
【題目】BaCl2可用于電子、儀表等工業。以毒重石(主要成分為BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等雜質)為原料,模擬工業制取BaCl2·2H2O的流程如下圖所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)鹽酸浸取時需要適當加熱的原因是_________。
(2)用37%的鹽酸配制15%的鹽酸需用到的儀器有________(填字母)
A.量筒 B.燒杯 C.容量瓶 D.玻璃棒
(3)濾渣I的成分為__________;
(4)Mg(OH)2的溶度積常數Ksp=_______,加入H2C2O4時發生的離子反應為_______,加入H2C2O4應避免過量,其原因是_________。
(5)母液中除了含有Ba2+、Cl—外,還含有大量的_________(填離子符號);
(6)濾渣III(不含結晶水)是結石的主要成分濾渣Ⅲ經過洗滌干燥后在空氣中進行熱重分析,取128.0g該純凈物,在200~470℃灼燒,最后得到100.0g產物,200~470℃時發生反應的化學方程式為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com