
【題目】研究含碳化合物的結構與性質,對生產、科研等具有重要意義。
(1)某同學畫出基態碳原子的核外電子排布圖:![]() ,該電子排布圖違背了__;CH3+、-CH3、CH3-都是重要的有機反應中間體。CH3+、CH3-的空間構型分別為___、____。
,該電子排布圖違背了__;CH3+、-CH3、CH3-都是重要的有機反應中間體。CH3+、CH3-的空間構型分別為___、____。
(2)冠醚是由多個二元醇分子之間失水形成的環狀化合物。X、Y、Z是常見的三種冠醚,其結構如圖所示。它們能與堿金屬離子作用,并且隨著環的大小不同而與不同金屬離子作用。
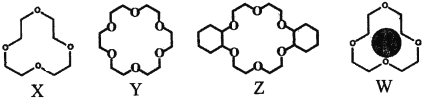
①Li+與X的空腔大小相近,恰好能進入到X的環內,且Li+與氧原子的一對孤電子對作用形成穩定結構W(如圖)。基態鋰離子核外能量最高的電子所處能層符號為___________;
②冠醚Y能與K+形成穩定結構,但不能與Li+形成穩定結構。理由是___________。
③烯烴難溶于水,被KMnO4水溶液氧化的效果較差。若烯烴中溶入冠醚Z,氧化效果明顯提升。
i.水分子中氧的雜化軌道的空間構型是___________,H-O鍵鍵角___________(填“>”“<”或“=”)109°28′
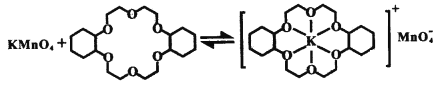
ii.已知:冠醚Z與KMnO4可以發生下圖所示的變化。加入冠醚Z后,烯烴的氧化效果明顯提升的原因是___________。
【答案】洪特規則 平面三角形 三角錐形 K Li+半徑比Y的空腔小得多,不易與空腔內氧原子的孤電子對作用形成穩定結構 正四面體 < 冠醚可溶于烯烴,進入冠醚中的K+因靜電作用將MnO4-帶入烯烴中,增大烯烴與MnO4-接觸機會,提升氧化效果
【解析】
(1)當電子排布在同一能級的不同軌道時,基態原子中的電子總是優先單獨占據一個軌道,而且自旋狀態相同;根據價層電子對個數=σ鍵個數+孤電子對個數計算判斷;
(2)①基態鋰離子核外只有1s能級上有電子;②冠醚Y空腔較大,Li+半徑較小;③i.水分子中氧原子的價層電子對個數是4;水分子中O原子含有2個孤電子對,孤電子對之間的排斥力大于成鍵電子對和孤電子對之間的排斥力;ii.根據相似相溶原理分析解答。
(1)2p軌道上的2個電子沒有分占不同軌道,該電子排布圖違背了洪特規則;CH3+中心碳原子的價層電子對個數=3+![]() =3,采用sp2雜化,為平面三角形結構,而CH3-中心碳原子的價層電子對個數=3+
=3,采用sp2雜化,為平面三角形結構,而CH3-中心碳原子的價層電子對個數=3+![]() =4,采用sp3雜化,為三角錐形,故答案為:洪特規則;平面三角形;三角錐形;
=4,采用sp3雜化,為三角錐形,故答案為:洪特規則;平面三角形;三角錐形;
(2)①基態鋰離子核外只有1s能級上有電子,為K層上的電子,所以其能層符號為K,故答案為:K;
②冠醚Y空腔較大,Li+半徑較小,Li+半徑遠遠小于Y空腔,導致該離子不易與氧原子的孤電子對形成配位鍵,所以得不到穩定結構,故答案為:Li+半徑比Y的空腔小很多,不易與空腔內O原子的孤電子對作用形成穩定結構;
③i.水分子中氧原子的價層電子對個數是4,采用sp3雜化,含有2個孤電子對,氧的雜化軌道的空間構型為四面體;水分子中O原子含有2個孤電子對,孤電子對之間的排斥力大于成鍵電子對和孤電子對之間的排斥力,導致水分子中鍵角小于甲烷分子之間鍵角,小于109°28′,故答案為:四面體;<;
ii.根據相似相溶原理知,冠醚可溶于烯烴,加入冠醚中的鉀離子因靜電作用將高錳酸根離子帶入烯烴中,增大反應物的接觸面積,提高氧化效果,故答案為:冠醚可溶于烯烴,加入冠醚中的鉀離子因靜電作用將高錳酸根離子帶入烯烴中,增大反應物的接觸面積,提高氧化效果。


科目:高中化學 來源: 題型:
【題目】甲醛(![]() )在Ni催化作用下加氫可得甲醇(CH3OH),以下說法中正確的是
)在Ni催化作用下加氫可得甲醇(CH3OH),以下說法中正確的是
A. 甲醛分子間可以形成氫鍵B. 甲醛分子和甲醇分子內C原子均采取sp2雜化。
C. 甲醛為極性分子D. 甲醇的沸點遠低于甲醛的沸點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列說法正確的是( )
A. 取等體積、同濃度的醋酸和鹽酸溶液與足量Zn反應,產生的氫氣量一樣多。
B. 用HF溶液做導電性實驗,燈泡很暗,則一定說明HF為弱電解質。
C. 稀釋醋酸溶液,溶液中所有離子濃度都減少。
D. 氨水稀釋時,![]() 不斷減少
不斷減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀 (K2FeO4)是一種新型、高效、多功能水處理劑,是比Cl2、O3、ClO2、KMnO4氧化性更強,無二次污染的綠色水處理劑。工業是先制得高鐵酸鈉,然后在低溫下,在高鐵酸鈉溶液中加入KOH至飽和就可析出高鐵酸鉀(K2FeO4)。濕法制備的主要反應方程為:2Fe(OH)3+3ClO-+4OH-=2FeO42- +3Cl-+5H2O,干法制備的主要反應方程為:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑ 下列有關說法不正確的是
A.低溫下,高鐵酸鉀的溶解度比高鐵酸鈉更小
B.濕法制備中每生成1mol Na2FeO4 轉移3mol電子
C.干法制備中還原劑與氧化劑的物質的量之比為1:3
D.K2FeO4處理水時,不僅能消毒殺菌,還能除去水體中的H2S、NH3等,生成的Fe(OH)3膠體還能吸附水中的懸浮雜質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度時,將1 mol A和2 mol B放入容積為5 L的某密閉容器中發生反應A(s)+2B(g)![]() C(g)+2D(g),經5 min后,測得容器內B的濃度減少了0.2 mol/L。下列敘述中錯誤的是
C(g)+2D(g),經5 min后,測得容器內B的濃度減少了0.2 mol/L。下列敘述中錯誤的是
A. 在5 min內該反應用C的濃度變化表示的反應速率為0.02 mol/(Lmin)
B. 5 min時,容器內D的濃度為0.2 mol/L
C. 該可逆反應隨著反應的進行,容器內壓強逐漸增大
D. 5 min時,容器內氣體總的物質的量為3 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素,離子方程式為2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化),實驗裝置如圖甲所示:

實驗序號 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)該實驗探究的是_________________________________因素對化學反應速率的影響。
(2)若實驗①在2 min末收集了4.48 mL CO2(標準狀況下),則在2 min末,c(MnO4-)=________ mol·L-1(假設混合溶液的體積為50 mL)。
(3)小組同學發現反應速率變化如圖乙,其中t1~t2時間內速率變快的主要原因可能是:
①產物Mn2+是反應的催化劑,②_______________________________
Ⅱ:當溫度高于500 K時,科學家成功利用二氧化碳和氫氣合成了乙醇,這在節能減排、降低碳排放方面具有重大意義。回答下列問題:
(1)該反應的化學方程式為___________________________________
(2)在恒溫恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________________
a.體系壓強不再改變 b.H2的濃度不再改變
c.氣體的密度不隨時間改變 d.單位時間內消耗H2和CO2的物質的量之比為3∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法錯誤的是
A.食物中的營養物質主要包括:糖類、油脂、蛋白質、維生素、無機鹽和水
B.燃燒相同體積的管道煤氣(主要成分CO和H2)和天然氣,管道煤氣消耗氧氣體積大
C.油脂沒有固定的熔沸點,是食物中產生能量最高的營養物質
D.金屬鈉和碳酸鈉溶液都可以用來區分乙醇、乙酸和苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表所列各組物質中,物質之間通過一步反應能實現如圖所示轉化的是( )
X | Y | Z | 物質轉化關系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:NO2(g) + SO2(g)![]() SO3(g) + NO(g) ,起始時向某密閉容器中通入1 mol NO2 、 2 mol S18O2,.反應達到平衡后,下列有關說法正確的是:
SO3(g) + NO(g) ,起始時向某密閉容器中通入1 mol NO2 、 2 mol S18O2,.反應達到平衡后,下列有關說法正確的是:
A.NO2中不可能含18OB.有1 mol N18O生成
C.S18O2的物質的量不可能為0. 8 molD.SO2、SO3、NO、NO2均含18O時,說明該反應達到平衡
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com