
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
分析 在氧化還原反應中氧化劑得到的電子數等于還原劑失去的電子數,根據轉移電子數相等確定還原產物中N元素的化合價,從而確定還原產物.
解答 解:假設金屬元素化合價由0價變為+1價,設還原產物中N元素化合價為x,根據轉移電子相等得2×(1-0)=1×(5-x),x=3;
假設金屬元素化合價由0價變為+2價,設還原產物中N元素化合價為y,根據轉移電子相等得2×(2-0)=1×(5-y),y=1;
假設金屬元素化合價由0價變為+3價,設還原產物中N元素化合價為z,根據轉移電子相等得2×(3-0)=1×(5-z),z=-1;
A.N2O中N元素化合價為+1,所以符合,故A正確;
B.NO中N元素化合價為+2價,不符合,故B錯誤;
C.NO2中N元素化合價為+4價,不符合,故C錯誤;
D.N2中N元素化合價為0價,不符合,故D錯誤;
故選A.
點評 本題考查氧化還原反應計算,側重考查學生發散思維能力及計算能力,利用轉移電子守恒解答即可,注意:金屬單質未知,所以其化合價要討論,為易錯點.


科目:高中化學 來源: 題型:解答題
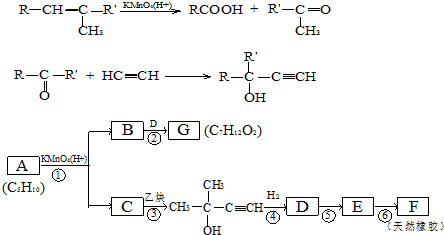
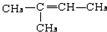 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2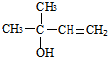 $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$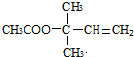 +H2O;
+H2O; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半徑:X<R<T | |
| C. | 最簡單氣態氫化物穩定性:T>R>Y | |
| D. | 最高價氧化物的水化物酸性:T>R>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| AgCl | Agl | Ag2S | |
| KSP(單位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀轉化的實質就是沉淀溶解平衡的移動 | |
| B. | 溶解度小的沉淀可以轉化為溶解度更小的沉淀 | |
| C. | AgCl固體在等物質的量濃度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃時,在飽和AgCl、Agl、Ag2S溶液中,所含Ag+的濃度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 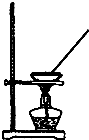 如圖所示裝置獲得碳酸氫鈉固體 | B. | 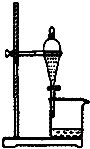 如圖所示裝置分離乙酸和乙酸乙酯 | ||
| C. | 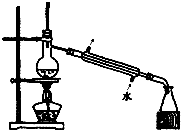 如圖所示裝置制取少量蒸餾水 | D. | 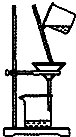 如圖所示裝置提純氫氧化鐵膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫時,某溶液中由水電離出來的c(H+)和c(OH-)的乘積為1×10-24,該溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- | |
| B. | 向1 mo1•L-l CH3COOH溶液中加入少量CH3COONa固體,由于CH3COONa水解顯堿性,所以溶液的pH升高 | |
| C. | 25℃時,將a mo1•L-l氨水與0.01 moI•L-1鹽酸等體積混合,反應完全時溶液中c(NH4+)=c(C1-),用含a的代數式表示反應完全時NH3•H2O的電離常數Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 已知298K時,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol•L-1,c(CO32-)=0.0001 mol•L-1,此時Mg2+和CO32-不能共存 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com