
| A. | Na2FeO4在酸性溶液中不穩定,與水反應生成Fe3+和O2,離子方程式為:4FeO42-+10H2O+4Fe3+=20OH-+3O2↑ | |
| B. | 工業上可用FeCl3、NaOH、NaClO三種物質反應制得NaFeO4離子方程式為:2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O | |
| C. | NaFeO4消毒殺菌時得到的Fe3+可以凈水,Fe3+能產生凈水物質的原因是:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | 工業上可用鐵做陽極,電解濃NaOH溶液的方法制Na2FeO4,陽極的電極反應為:Fe-6e-+8OH-=FeO42-+4H2O |
分析 A.酸性溶液中不能生成氫氧根離子;
B.FeCl3、NaOH、NaClO三種物質反應制得Na2FeO4,發生氧化還原反應,Cl元素得到電子生成NaCl;
C.Na2FeO4還原產物為Fe3+,Fe3+水解得到膠體,具有吸附性,能夠吸附水中固體雜質顆粒;
D.鐵做陽極為活性電極,Fe失去電子.
解答 解:A.酸性溶液中不能生成氫氧根離子,則離子方程式為4FeO42-+20 H+═4Fe3++10H2O+3O2↑,故A錯誤;
B.FeCl3、NaOH、NaClO三種物質反應制得Na2FeO4,發生氧化還原反應,Cl元素得到電子生成NaCl,由電子、原子守恒可知,反應為2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O,故B正確;
C.Na2FeO4還原產物為Fe3+,Fe3+水解得到膠體,水解離子反應為Fe3++3H2O?Fe(OH)3(膠體)+3H+,故C正確;
D.鐵做陽極,Fe失去電子,則陽極的電極反應為:Fe-6e-+8OH-═FeO42-+4H2O,故D正確;
故選A.
點評 本題考查了離子方程式的書寫,涉及氧化還原方程式書寫、電解池電極反應書寫,鹽類水解的離子方程式書寫,題目難度中等,注意電解池工作原理.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
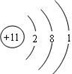 ;F元素在周期表中的位置是第三周期ⅦA族;
;F元素在周期表中的位置是第三周期ⅦA族;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
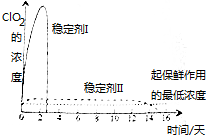 目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2與Cl2的氧化性質相近,在自來水消毒和果蔬保鮮等方面應用廣泛.有關數據見下表:
目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2與Cl2的氧化性質相近,在自來水消毒和果蔬保鮮等方面應用廣泛.有關數據見下表:| 化學式 | Cl2O | ClO2 | Cl2O7 |
| 沸點/℃ | 3.8 | 11.0 | 82.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃鹽酸與鐵屑反應:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液與稀H2SO4反應:CO32-+2H+=H2O+CO2↑ | |
| D. | 鈉與CuSO4溶液反應:2Na+Cu2+=Cu↓+2Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
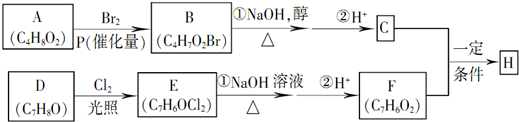
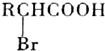
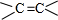 ;
;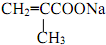 +NaBr+2H2O,該反應的類型為消去反應;
+NaBr+2H2O,該反應的類型為消去反應; $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$ +H2O.
+H2O.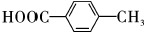 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
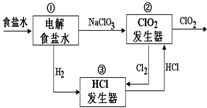 利用食鹽水制取ClO2的工業流程如右圖所示,
利用食鹽水制取ClO2的工業流程如右圖所示,| A. | 裝置①中H2是陰極產物 | |
| B. | 裝置②的陰極電極反應式為2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 該流程中Cl2、NaCl都可以循環利用 | |
| D. | 為了使H2完全轉化為HCl,需要向裝置③中補充Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ”的同分異構體有( )
”的同分異構體有( )| A. | 7種 | B. | 9種 | C. | 11種 | D. | 13種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com