
| A. | HBr、KOH、CaCO3、H2O都是強電解質 | |
| B. | Na2O2、CaO、Al2O3都是堿性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 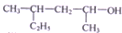 的名稱為4-甲基-2-己醇 的名稱為4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的質子數為94,中子數為238,電子數為144 |
分析 A.水溶液中或熔融狀態下完全電離的電解質為強電解質;
B.和酸反應生成鹽和水的氧化物為堿性氧化物,和堿反應生成鹽和水的氧化物為酸性氧化物,發生的都不是氧化還原反應;
C.選取含連醇羥基碳原子在內的最長碳鏈,從離羥基近的一端開始編號,寫出名稱,注意要寫出官能團、支鏈的位置和名稱;
D.原子符號中質子數+中子數=質量數,計算分析判斷.
解答 解:A.HBr、KOH、CaCO3水溶液中或熔融狀態完全電離都是強電解質,H2O部分電離屬于弱電解質,故A錯誤;
B.Na2O2和酸反應生成鹽、水和氧氣,不是堿性氧化物,CaO是堿性氧化物,Al2O3和酸堿都反應,屬于兩性氧化物,SiO2、SO2都和堿反應生成鹽和水是酸性氧化物、NO2 和堿反應發生的是氧化還原反應,不是酸性氧化物,故B錯誤;
C.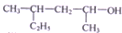 依據命名方法得當名稱為4-甲基-2-己醇,故C正確;
依據命名方法得當名稱為4-甲基-2-己醇,故C正確;
D.${\;}_{94}^{238}$Pu的質子數為94,中子數=238-94=144,電子數為94,故D錯誤;
故選C.
點評 本題考查了物質分類、有機物命名、原子結構等知識點,主要是強電解質、酸性氧化物、堿性氧化物概念的理解應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 步驟Ⅰ中減少的3 g固體一定是混合物 | |
| B. | 步驟Ⅱ中質量減少的物質一定是Cu | |
| C. | 根據步驟Ⅰ、Ⅱ可以判斷混合物X的成分為Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根據步驟Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
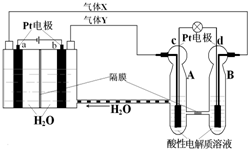 RFC是一種將水電解技術與氫氧燃料電池技術相互結合的可充電電池,RFC工作原理如圖所示.則下列有關說法正確的是( )
RFC是一種將水電解技術與氫氧燃料電池技術相互結合的可充電電池,RFC工作原理如圖所示.則下列有關說法正確的是( )| A. | c電極發生還原反應,B池中H+通過隔膜進入A池 | |
| B. | b電極上發生的電極反應是:2H2O+2e-═H2↑+2OH- | |
| C. | 轉移0.1mol電子時,a電極產生標準狀況O21.12L | |
| D. | d電極上發生的電極反應是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
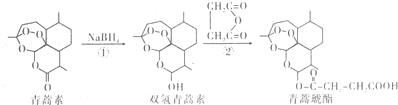
| A. | 青蒿素分子中所有碳原子在同一平面內 | |
| B. | 反應①屬于還原反應,反應②理論上原子利用率可達100% | |
| C. | 雙氫青蒿素屬于芳香化合物 | |
| D. | 青蒿琥酯可以發生水解、酯化以及加聚反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
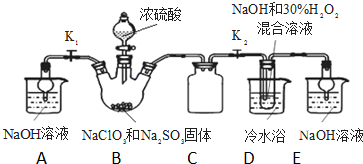 亞氯酸鈉(NaClO2)是重要漂白劑.探究小組開展如下實驗,回答下列問題:
亞氯酸鈉(NaClO2)是重要漂白劑.探究小組開展如下實驗,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當a=0.1時,發生的反應為2I-+Br2═I2+2Br- | |
| B. | 當a=0.25時,發生的反應為2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 當溶液中I-有一半被氧化時,c(I-):c(Br-)=1:1 | |
| D. | 當0.2<a<0.3時,溶液中各離子濃度的關系為2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
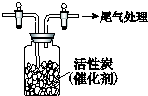 某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.
某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com