
| 實驗步驟 | 實驗現象 | 結論 |
| 取少量濾液,滴加適量K2CO3溶液 | 若出現白色沉淀 | 濾液中含Ca(OH)2 |
| 若無白色沉淀 | 濾液中無Ca(OH)2 | |
| 另取少量濾液,滴入適量鹽酸 | 若出現氣泡 | 濾液中含Na2CO3 |
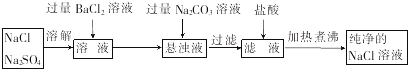
分析 (1)①CaO與水反應后生成氫氧化鈣,再與碳酸鈉反應生成碳酸鈣;
②Ca(OH)2 易與K2CO3溶液反應生成沉淀,Na2CO3與鹽酸反應生成氣體,以此檢驗;
(2)由分離流程可知,溶解后加氯化鋇發生BaCl2+Na2SO4═BaSO4↓+2NaCl,再加碳酸鈉發生BaCl2+Na2CO3═BaCO3↓+2NaCl,過濾后加鹽酸發生2HCl+Na2CO3═2NaCl+H2O+CO2↑,加熱煮沸得到純凈的NaCl,以此來解答.
解答 解:(1)①腌制松花蛋的配料有生石灰,加入水發生:CaO+H2O=Ca(OH)2,生成的Ca(OH)2與純堿發生Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,
故答案為:CaO+H2O=Ca(OH)2;
②由Ca(OH)2 易與K2CO3溶液反應生成沉淀,滴加適量K2CO3溶液,如有白色沉淀,則說明濾液中含有Ca(OH)2,否則無Ca(OH)2;
由Na2CO3與鹽酸反應生成氣體,取少量濾液,加入過量鹽酸,如有氣泡生成,則說明含有Na2CO3,如無氣泡生成,則說明沒有Na2CO3.
若實驗①檢驗出有Ca(OH)2,則肯定沒有Na2CO3的存在;
故答案為:
| 實驗步驟 | 實驗現象 | 結論 |
| 取少量濾液,滴加適量K2CO3溶液 | 若出現白色沉淀 | 濾液中含Ca(OH)2 |
| 若無白色沉淀 | 濾液中無Ca(OH)2 | |
| 另取少量濾液,滴入適量鹽酸 | 若出現氣泡 | 濾液中含Na2CO3 |
點評 本題考查混合物分離提純,為高頻考點,把握物質的性質、混合物分離提純、發生的反應為解答的關鍵,側重分析與應用能力的考查,注意元素化合物性質的應用,題目難度不大.


科目:高中化學 來源:2016-2017學年云南省高一9月月考化學卷(解析版) 題型:選擇題
甲、乙、丙、丁分別是氫氧化鈣溶液、硝酸鉀溶液、碳酸鈉溶液、鹽酸中的一種。已知甲和丙可以反應,甲和丁也可以反應,則下列說法正確的是
A.甲一定是氫氧化鈣溶液 B.乙一定是硝酸鉀溶液
C.丙不可能是碳酸鈉溶液 D.丁只能是鹽酸
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽師大附中高二上10月月考化學卷(解析版) 題型:選擇題
加熱N2O5,依次發生分解反應:①N2O5(g) N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g) N2O(g)+O2(g)。在體積為2 L的恒容密閉容器中充入8 mol N2O5,加熱到T℃時O2和N2O3的物質的量分別為9 mol、3.4 mol,則T℃時
N2O(g)+O2(g)。在體積為2 L的恒容密閉容器中充入8 mol N2O5,加熱到T℃時O2和N2O3的物質的量分別為9 mol、3.4 mol,則T℃時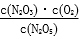 為
為
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽師大附中高二上10月月考化學卷(解析版) 題型:選擇題
在一 定條件下,對于A2(g)+3B2(g)
定條件下,對于A2(g)+3B2(g) 2AB3(g)反應來說,下列所表示的化學反應速率中最大的
2AB3(g)反應來說,下列所表示的化學反應速率中最大的 是
是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=40 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
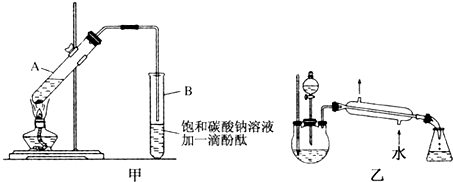
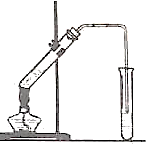 如圖,在左試管中先加入2mL95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.
如圖,在左試管中先加入2mL95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖,在左試管中先加入2mL 95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗
如圖,在左試管中先加入2mL 95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗查看答案和解析>>
科目:高中化學 來源: 題型:解答題
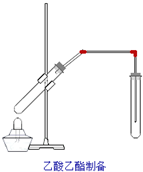
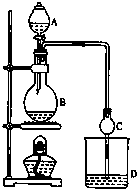 某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.
某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.| 試劑 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點/℃ | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 熔點(℃) | 沸點(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 濃硫酸 | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
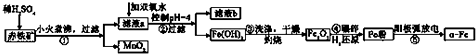
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com