
高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池能長時間保持穩定的放電電壓。高鐵電池的總反應為3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述錯誤的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述錯誤的是
A.放電時正極附近溶液的堿性增強
B.放電時每轉移3mol電子,正極有1molK2FeO4被還原
C.充電時鋅極與外電源負極相連
D.充電時陽極反應為Fe(OH)3-3e-+H2OFeO42-+5H+
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年天津市河東區高二上學期期中質檢化學試卷(解析版) 題型:填空題
某研究小組向某2 L密閉容器中加入一定量的固體A和氣體B,發生反應A(s)+2B(g) 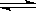 D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃時,反應進行到不同時間測得各物質的物質的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃時,反應進行到不同時間測得各物質的物質的量如表:
時間(min) 物質的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1 ℃時,該反應的平衡常數K=_______________。
(2)30 min后,只改變某一條件,反應重新達到平衡,根據表中的數據判斷改變的條件可能是________(填字母編號)。
a.通入一定量的B
b.加入一定量的固體A
c.適當縮小容器的體積
d.升高反應體系溫度
e.同時加入0.2 mol B、0.1 mol D、0.1 mol E
(3) 維持容器的體積和溫度T1℃不變,若向該容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,達到平衡后,與表格中20分鐘時各物質的濃度完全相同,則投入固體A的物質的量n的取值范圍是_______________。
(4)維持容器的體積和溫度T1℃不變,各物質的起始物質的量為:n(A)=1.0mol,n(B)=3.0mol,n(D)= amol,n(E)= 0mol,達到平衡后,n(E)= 0.50mol,則a= 。
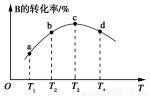
(5)若該密閉容器絕熱,實驗測得B的轉化率隨溫度變化的示意圖如圖所示。由圖可知,Q________0(填“大于”或“小于”),c點v正________v逆(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化學 來源:2016屆內蒙古高三上學期期中化學試卷(解析版) 題型:實驗題
為探究碳鐵合金與濃硫酸在酸性條件下反應的部分產物并測定碳鐵合金中鐵元素的質量分數,某化學小組設計了下圖所示的實驗裝置,并完成以下實驗探究。
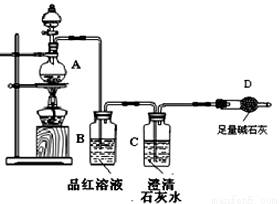
(1)往圓底燒瓶中加入m g鐵碳合金,并滴入過量濃硫酸,未點燃酒精燈前,A、B均無明顯現象,其原因是:①常溫下,Fe在濃硫酸中 ;②常溫下,碳和濃硫酸不反應。
(2)裝置B的作用是 。
(3)甲同學觀察到裝置C中有白色沉淀生成,他得出了使澄清石灰水變渾濁的氣體是二氧化碳。裝置A中能產生二氧化碳的化學方程式為 。
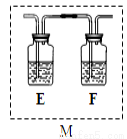
(4)乙同學認為甲同學的結論是錯誤的,他認為為了確認二氧化碳的存在,需在裝置B-C之間添加裝置M。裝置E、F中盛放的試劑分別是酸性高錳酸鉀、 。重新實驗后 觀察到裝置F中的現象是 。
觀察到裝置F中的現象是 。
(5)有些同學認為合金中鐵元素的質量分數可用KMnO4溶液來測定。
(5Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
測定鐵元素質量分數的實驗步驟如下:
I.往燒瓶A中加入過量的還原劑銅使溶液中的Fe3+完全轉化為Fe2+,過濾,得到濾液B;
II.將濾液B稀釋為250 mL;
III.取稀釋液25.00 mL,用濃度為c mol·L—1的酸性KMnO4溶液滴定,三次滴定實驗所需KMnO4溶液體積的平均值為V mL。
①步驟 Ⅱ中,將濾液B稀釋為250 mL需要用到的玻璃儀器除燒杯、玻璃棒、膠頭滴管外,還必須要用到的是 ;
Ⅱ中,將濾液B稀釋為250 mL需要用到的玻璃儀器除燒杯、玻璃棒、膠頭滴管外,還必須要用到的是 ;
②滴定過程中 (填“需要”或“不需要”)加入指示劑
③鐵碳合金中鐵元素的質量分數為 。
查看答案和解析>>
科目:高中化學 來源:2016屆內蒙古高三上學期期中化學試卷(解析版) 題型:選擇題
下列關于物質應用說法正確的是( )
A、小蘇打是面包發酵粉主要成分之一
B、鹽類都可作調味品
C、鋁罐可久盛食醋
D、生石灰用作食品抗氧化劑
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高二上期中化學卷(解析版) 題型:填空題
(1)家用液化石油氣的主要成分之一是甲烷,當16 kg甲烷完全燃燒并生成二氧化碳氣體和液態水時,放出的熱量為8.9×105 kJ。已知1mol液態水汽化時需要吸收44 kJ熱量。試寫出甲烷燃燒生成水蒸氣的熱化學方程式: 。
(2)有同學用甲烷與空氣為原料制作一燃燒電池,若以稀硫酸為電解質溶液時,其負極反應式為 。
(3)已知拆開1 mol H-H鍵,1 molN-H鍵,1 molN≡N鍵分別需要的能量是akJ、bkJ、ckJ,則N2與H2反應生成NH3的熱化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高二上期中化學卷(解析版) 題型:選擇題
下列敘述正確的是
A.95℃純水的pH<7,說明加熱可導致水呈酸性
B.25℃時,在純水中加入強堿溶液不會影響水的離子積常數
C.pH=3的醋酸溶液加水稀釋10倍后pH=4
D.pH=3和pH=5的鹽酸各10mL混合所得溶液的pH=4
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高二上期中化學卷(解析版) 題型:選擇題
下列水溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.c(H+)=c(OH-)
D.pH=3的酸與pH=11的堿等體積混合后的溶液
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省高二上期中化學卷(解析版) 題型:選擇題
反應CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某溫度自發向右進行,若反應的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,則下列正確的是( )
A.ΔH>0,ΔH-TΔS<0 B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0 D.ΔH<0,ΔH-TΔS<0
查看答案和解析>>
科目:高中化學 來源:2017屆內蒙古高三上月考四化學卷(解析版) 題型:選擇題
短周期元素W、X、Y、Z原子序數依次增大。X是原子半徑最大的短周期元素,Y原子最外層電子數和電子層數相等,W、Z同主族且原子序數之和與X、Y原子序數之和相等。下列說法中不正確的是
A. 含Y元素的鹽溶液可呈堿性
B. X和W形成的化合物可含非極性共價鍵
C. Y單質與Z的最高價氧化物對應水化物反應一定產生H2
D. W的氣態氫化物熱穩定性強于Z的氣態氫化物熱穩定性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com