設阿伏加德羅常數的值為NA.則下列說法正確的是( )
A.常溫常壓下,18.0 g NH4+中所含的質子數為10 NA
B.室溫下,8g甲烷含有共價鍵數為2NA
C.111gCaCl2晶體中所含共用電子對的數目為2NA
D.常溫下,2.7g鋁片投入足量的濃硫酸中,鋁失去的電子數為0.3NA
【答案】
分析:A、質量換算物質的量結合離子結構計算質子數;
B、質量換算物質的量結合甲烷分子結構計算共價鍵數;
C、依據氯化鈣是離子化合物分析判斷;
D、依據常溫下鋁在濃硫酸中鈍化不再反應分析判斷;
解答:解:A、18.0 g NH
4+物質的量=
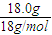
=1mol,所含質子數為1mol×(7+1×4-1)=10mol,即10N
A,故A正確;
B、1mol甲烷分子含共價鍵4mol,8g甲烷物質的量為0.5mol,含共價鍵為0.5mol×4=2mol,故B正確;
C、氯化鈣是離子化合物,不存在共用電子對,故C錯誤;
D、常溫下,2.7g鋁片投入足量的濃硫酸中鈍化,鋁不會繼續反應,故D錯誤.
故選AB.
點評:本題考查了阿伏伽德羅常數的應用,主要考查蒸餾換算物質的量來計算微粒數、共價鍵數,關鍵是化合物的類別判斷和常溫下鋁在濃硫酸中鈍化.

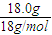 =1mol,所含質子數為1mol×(7+1×4-1)=10mol,即10NA,故A正確;
=1mol,所含質子數為1mol×(7+1×4-1)=10mol,即10NA,故A正確;
