
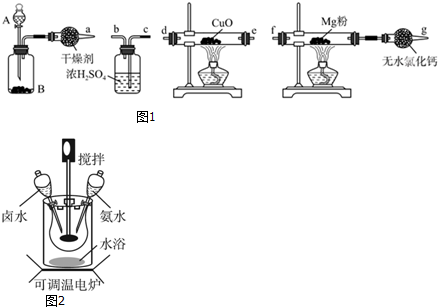
分析 (1)該實驗的原理是將:濃氨水滴加到生石灰或氫氧化鈉固體上,得到氨氣,利用氨氣的還原性,與氧化銅反應得到氮氣,干燥的氮氣與鎂粉反應得到氮化鎂;
①濃氨水滴入生石灰溶解放熱,使一水合氨分解生成氨氣;
②用裝置B制備氨氣,通過裝置中氧化銅氧化氨氣生成銅、氮氣和水,生成氣體通過濃硫酸干燥得到純凈干凈的氮氣進入裝置和鎂反應生成氮化鎂,最后無水氯化鈣是防止空氣中水蒸氣進入硬質玻璃管,氮化鎂易與水反應;
③氨氣有還原性,能還原氧化銅,生成物之一是空氣的主要成分為氮氣,氨氣被氧化銅氧化生成銅、氮氣和水;
④氮化鎂和水易發生反應生成氫氧化鎂和氨氣;
(2)此實驗的原理是:按一定的固液比向三頸燒瓶中加入含鎂復鹽MgCO3(NH4)2CO3•H2O和蒸餾水,放在恒溫水浴中加熱,開啟攪拌器同時加入氨水,待溫度達到40℃時,滴加鹵水(氯化鎂溶液)并繼續滴入氨水,待反應一段時間后,過濾洗滌干燥,得到堿式碳酸鎂產品;
①反應需要的溫度低于100°C,需要水浴加熱,可以使反應物受熱均勻;
②40℃復鹽開始熱解生成MgCO3•3H2O,根據元素守恒和部分生成物可寫出化學方程式;此時開始滴加鹵水的目的是吸收熱解生成的氨氣和二氧化碳;
③若堿式碳酸鎂的質量mg(不考慮微量雜質),充分灼燒后,要確定其組成,需要測得剩余固體的質量,產生的二氧他碳氣體體積能計算得到組成;
解答 解:(1)濃氨水滴加到生石灰或氫氧化鈉固體上,得到氨氣,利用氨氣的還原性,與氧化銅反應得到氮氣,干燥的氮氣與鎂粉反應得到氮化鎂;
①濃氨水滴入生石灰或氫氧化鈉固體溶解放熱,使一水合氨分解生成氨氣,
故答案為:生石灰或氫氧化鈉;
②用裝置B制備氨氣,通過裝置中氧化銅氧化氨氣生成銅、氮氣和水,生成氣體通過濃硫酸干燥得到純凈干凈的氮氣進入裝置和鎂反應生成氮化鎂,最后無水氯化鈣是防止空氣中水蒸氣進入硬質玻璃管,氮化鎂易與水反應,裝置按照氣流的方向連接裝置順序為:adecbf,
故答案為:decbf;
③氨氣有還原性,能還原氧化銅,生成物之一是空氣的主要成分為氮氣,氨氣被氧化銅氧化生成銅、氮氣和水,反應的化學方程式為:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,
故答案為:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu;
④氮化鎂和水易發生反應生成氫氧化鎂和氨氣,化學方程式為:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
故答案為:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)按一定的固液比向三頸燒瓶中加入該含鎂復鹽和蒸餾水,放在恒溫水浴中加熱,開啟攪拌器同時加入氨水,待溫度達到40℃時,滴加鹵水(氯化鎂溶液)并繼續滴入氨水,待反應一段時間后,過濾洗滌干燥,得到堿式碳酸鎂產品;
①選擇水浴加熱方式的優點是,可以使反應物受熱均勻;
故答案為:使反應物受熱均勻,溫度容易控制;
②40℃復鹽開始熱解生成MgCO3•3H2O,根據元素守恒可知,復鹽開始熱解生成MgCO3•3H2O,并有氣體產生,該氣體應為二氧化碳和氨氣,所以反應的化學方程式為MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑,此時開始滴加鹵水的目的是吸收生成的氨氣和二氧化碳,防止污染;
故答案為:MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑;
吸收復鹽熱解生成的氨氣和部分二氧化碳;
③已知制得的堿式碳酸鎂可表示為xMgCO3•yMg(OH)2•H2O.若堿式碳酸鎂的質量mg(不考慮微最雜質),充分灼燒后,要確定其組成,需要測得剩余固體的質量,產生的二氧他碳氣體體積,故選bd;
故答案為:bd.
點評 本題考查了物質組成和含量的實驗探究過程分析,物質性質、實驗基本操作、化學方程式書寫等知識,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 改變的條件 | 結論 |
| A | 升溫 | CO32-的水解平衡向右移動 |
| B | 加入AlCl3固體 | 產生大量氣體 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均減小 |
| D | 加入少量CH3COONa固體 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| a、b可能的關系 | 生成的沉淀的質量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
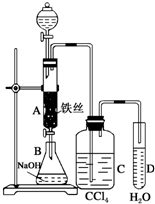 某化學課外小組用如圖所示的裝置制取溴苯.先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中.
某化學課外小組用如圖所示的裝置制取溴苯.先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com