

分析 (1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,則c(OH-)=10-11mol/L,c(H+)=1.0×10-3mol/L,依據pH=-lgc(H+)計算該溶液的pH;根據計算判斷HA為弱電解質,然后寫出其與氫氧化鈉溶液的反應的離子方程式;
②根據酸和堿的物質的量的相對大小確定溶液中的溶質,從而確定溶液的酸堿性,結合電離平衡、水解平衡、電荷守恒等確定溶液中各種離子濃度的相對大小;
③根據電荷守恒與物料守恒進行計算.
(2)根據官能團的性質以及變化判斷反應條件,-COOH具有酸性,可與NaHCO3反應生成-COONa,注意酚羥基不與NaHCO3反應,-COONa與HCl或H2SO4等強酸反應又可生成-COOH,酚羥基與NaOH或Na2CO3 反應生成酚羥基鈉,醇羥基與金屬鈉反應,以此判斷.
解答 解:(1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,根據水的離子積可得:c(OH-)=10-11mol/L、c(H+)=1.0×10-3mol/L,該溶液的pH=-lgc(H+)=3;說明HA在溶液中只能部分電離出氫離子,則HA為弱酸,該酸(HA)與NaOH溶液反應的離子方程式為:HA+OH-=A-+H2O,
故答案為:3;HA+OH-=A-+H2O;
②常溫下pH=11的NaOH溶液中c(OH-)=10-3mol•L-1,HA是弱酸,酸的濃度遠遠大于氫離子濃度,溶液中的溶質是酸和鹽,溶液呈酸性,所以溶液中氫離子濃度大于氫氧根離子濃度,酸根離子濃度大于鈉離子濃度,溶液中4種離子物質的量濃度大小關系為:c(A-)>c(Na+)>c(H+)>c(OH-),
故答案為:c(A-)>c(Na+)>c(H+)>c(OH-);
②0.2mol•L-1HA溶液與0.1mol•L-1NaOH溶液等體積混合后所得溶液中,由電荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒可得:2c(Na+)=c(A-)+c(HA),二者結合可得:c(H+)+c(HA)-c(OH-)=c(Na+)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
故答案為:0.05.
(2)根據官能團的性質以及變化判斷反應條件,-COOH具有酸性,可與NaHCO3反應生成-COONa,注意酚羥基不與NaHCO3反應,-COONa與HCl或H2SO4等強酸反應又可生成-COOH,酚羥基與NaOH或Na2CO3 反應生成酚羥基鈉,酚羥基鈉可與CO2反應生成酚羥基,醇羥基與金屬鈉反應,所以加入的化學試劑為:①NaHCO3;②H2SO4或HCl;③NaOH或Na2CO3;④CO2;⑤CNa,
故答案為:①NaHCO3;②H2SO4或HCl;③NaOH或Na2CO3;④CO2;⑤CNa.
點評 本題考查了酸堿混合后溶液定性判斷及溶液pH的計算、有機物的結構與性質,題目難度中等,注意掌握溶液酸堿性與溶液pH的關系,能夠根據電荷守恒、物料守恒、鹽的水解原理正確判斷溶液中各離子濃度大小.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
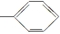 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.| A. | 4種 | B. | 5種 | C. | 6種 | D. | 7種 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
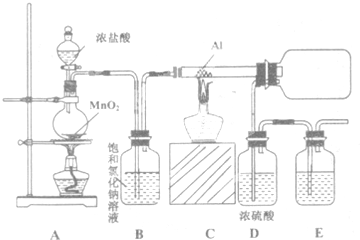
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 5min內平均反應速率vA=0.15mol•L-1•min-1 | |
| B. | 當同時對原平衡體系升高一定溫度和增加一定壓強時,達平衡后,C的物質的量分數為60%,則該反應的正反應為放熱反應 | |
| C. | 保持其他條件不變,若起始時向容器中加入0.5molA、0.5molB、1.5molC,則反應將向逆反應方向進行 | |
| D. | t℃,向2L密閉、恒容容器中加入等物質的量的A和B,反應達到平衡狀態時,C的物質的量分數仍為60%,則加入A的物質的量為1.6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 該反應的正反應是吸熱反應 | |
| B. | 100℃時,向體積為V1L的恒容密閉容器中充入2mol CO和4mol H2,達到平衡時,CO的轉化率為40%,則V1=12 | |
| C. | 250℃時,向體積為V2L的恒容密閉容器中充入3mol CO和3mol H2,達到平衡時,混合氣體中CO的體積分數為50% | |
| D. | 250℃時,向體積為V2L的恒容密閉容器中充入3mol CO和3mol H2,達到平衡時,混合氣體中CH3OH(g)的體積分數為62.5% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 25℃時,電離平衡常數:
25℃時,電離平衡常數:| 化學試 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 將足量的CO2不斷通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物質的量與所通入CO2的體積關系如圖所示.下列關于整個反應過程中的敘述錯誤的是( )
將足量的CO2不斷通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物質的量與所通入CO2的體積關系如圖所示.下列關于整個反應過程中的敘述錯誤的是( )| A. | Oa段反應的化學方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段與cd段所消耗CO2的體積相同 | |
| C. | bc段反應的離子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀減少是由于BaCO3固體的消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com