
| 實 驗 序 號 | 時間(min) 濃度(mol•L-1) 溫度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 該反應是吸熱反應,升溫正、逆反應速率增大 | |
| B. | 實驗3中 c3=1.2 mol•L-1 | |
| C. | 實驗1與實驗3比較,A的平衡轉化率之比為1:2 | |
| D. | 實驗2使用了催化劑,在0至10 min內平均速率υ(B)=0.02 mol•L-1•min-1 |
分析 A、加熱平衡向吸熱反應方向移動;
B、以10至20min為例求出反應速率進行比較;
C、實驗1與實驗3是等效平衡,所以A的平衡轉化率相等;
D、根據實驗1、2數據分析.
解答 解:A、比較實驗4和實驗1可知平衡時實驗4反應物A的濃度小,由實驗1到實驗4升高溫度,平衡右移,加熱平衡向吸熱反應方向移動,而且升高溫度正逆反應速率都加快,故A正確;
B、在實驗1中,反應在10至20min時間內平均速率為V=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,在實驗3中,反應在10至20min時間內平均速率為V=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,實驗1的其實濃度為1.0mol/L,由平衡時濃度可知在實驗3的起始濃度大于1.0mol/L,實驗1和實驗3是等效平衡,起始A的濃度為1.0mol/L時平衡濃度為0.5mol/L,而A的平衡濃度為0.6mol/L時,初起c3=1.2 mol•L-1,故B正確;
、實驗1與實驗3是等效平衡,所以A的平衡轉化率相等,則平衡轉化率之比為1:1,故C錯誤;
D、根據實驗1、2數據分析,溫度相同,達平衡后A的物質的量濃度相同,且B、D起始濃度為0,所以兩組實驗中A的起始濃度相同為1.0mol•L-1 ;溫度相同,達平衡后A的物質的量濃度相同,但達平衡時2組的時間較短,所以只能是加入催化劑,而v(A)=$\frac{0.4}{10}$=0.04mol/(L.min),所以υ(B)=0.02 mol•L-1•min-1,故D正確;
故選C.
點評 本題考查化學平衡的計算與影響因素、反應速率計算、平衡常數應用等,側重考查學生對數據的分析處理能力、知識遷移運用能力,題目難度中等.


 七彩題卡口算應用一點通系列答案
七彩題卡口算應用一點通系列答案科目:高中化學 來源: 題型:選擇題
| A. | 工業上用水吸收NO2生產硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰處理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu與稀硝酸反應制取硝酸銅:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明礬除去水中的懸浮顆粒物:Al3++3H2O?Al(OH)3(膠體)+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
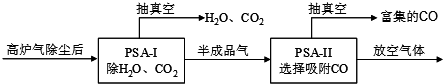
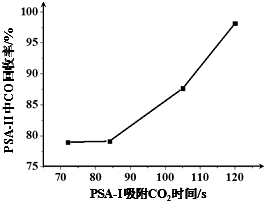
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 溫度范圍/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固體/g | 22.05 | 11.25 | 11.85 | 13.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
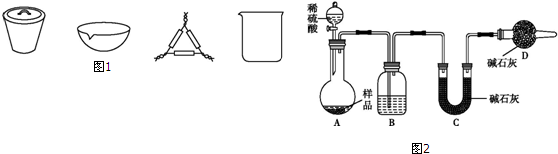
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
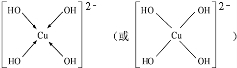
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com