
【題目】疊氮化鈉(NaN3)是汽車安全氣囊的主要成分,實驗室制取疊氮化鈉的實驗步驟如下:
①打開裝置D導管上的旋塞,加熱制取氨氣。
②加熱裝置A中的金屬鈉,使其熔化并充分反應后,再停止加熱裝置D并關閉旋塞。
③向裝置A中b容器內充入加熱介質并加熱到210~220℃,然后通入N2O。
④冷卻,向產物中加入乙醇(降低NaN3的溶解度),減壓濃縮結晶后,再過濾,并用乙醚洗滌,晾干。

(1)裝置B中盛放的藥品為____。
(2)步驟①中先加熱通氨氣一段時間的目的是____;步驟②氨氣與熔化的鈉反應生成NaNH2的化學方程式為____。步驟③中最適宜的加熱方式為___(填“水浴加熱”,“油浴加熱”)。
(3)生成NaN3的化學方程式為____。
(4)產率計算
①稱取2.0 g疊氮化鈉試樣,配成100 mL溶液,并量取10.00 mL溶液于錐形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸鈰銨[(NH4)2Ce(NO3)6]溶液40.00 mL[發生的反應為2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](雜質均不參與反應)。
③充分反應后滴入2滴鄰菲羅啉指示液,并用0.10 mol·L-1硫酸亞鐵銨[(NH4)2Fe(SO4)2]為標準液,滴定過量的Ce4+,終點時消耗標準溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。計算可知疊氮化鈉的質量分數為____(保留2位有效數字)。若其他操作及讀數均正確,滴定到終點后,下列操作會導致所測定樣品中疊氮化鈉質量分數偏大的是____(填字母代號)。
A.錐形瓶使用疊氮化鈉溶液潤洗
B.滴加六硝酸鈰銨溶液時,滴加前仰視讀數,滴加后俯視讀數
C.滴加硫酸亞鐵銨標準溶液時,開始時尖嘴處無氣泡,結束時出現氣泡
D.滴定過程中,將掛在錐形瓶壁上的硫酸亞鐵銨標準液滴用蒸餾水沖進瓶內
(5)疊氮化鈉有毒,可以使用次氯酸鈉溶液對含有疊氮化鈉的溶液進行銷毀,反應后溶液堿性明顯增強,且產生無色無味的無毒氣體,試寫出反應的離子方程式____。
【答案】堿石灰(或生石灰、氫氧化鈉固體) 排盡裝置中的空氣 2Na+2NH3![]() 2NaNH2+H2 油浴加熱 NaNH2+N2O
2NaNH2+H2 油浴加熱 NaNH2+N2O ![]() NaN3+H2O 65% AC ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
NaN3+H2O 65% AC ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
【解析】
(1)制備的氨氣中含有大量的水,B中盛放堿石灰干燥氨氣,
故答案為:堿石灰(或生石灰、氫氧化鈉固體);
(2)用氨氣排盡裝置中的空氣,防止加熱時空氣中的氧氣等能與鈉反應,步驟②制備NaNH2,還生成氫氣,反應方程式為:2Na+2NH3![]() 2NaNH2+H2;控制溫度210220℃,故選用油浴加熱,
2NaNH2+H2;控制溫度210220℃,故選用油浴加熱,
故答案為:排盡裝置中的空氣;2Na+2NH3![]() 2NaNH2+H2;油浴加熱;
2NaNH2+H2;油浴加熱;
(3) NaNH2和N2O在210220℃下反應生成NaN3和水,反應為:NaNH2+N2O ![]() NaN3+H2O,
NaN3+H2O,
故答案為:NaNH2+N2O ![]() NaN3+H2O;
NaN3+H2O;
(4)Ce4+的物質的量濃度總計為0.10 molL1×0.04 L=0.004 mol,分別與Fe2+和N3反應。其中與Fe2+按1:1反應消耗0.10 molL1×0.02 L=0.002 mol,則與N3按1:1反應也為0.002 mol,即10 mL所取溶液中有0.002 mol N3,原2.0 g疊氮化鈉試樣,配成100 mL溶液中有0.02 mol即1.3 g NaN3,所以樣品質量分數為![]() =65%;
=65%;
A. 使用疊氮化鈉溶液潤洗錐形瓶,使進入錐形瓶中溶質比所取溶液更多,滴定消耗的硫酸亞鐵銨標準液體積減小,疊氮化鈉溶液濃度偏大,故A正確;
B. 六硝酸鈰銨溶液實際取量大于40.00 mL,滴定消耗的硫酸亞鐵銨標準液體積增大,計算疊氮化鈉溶液濃度偏小,故B錯誤;
C. 滴定前無氣泡,終點時出現氣泡,則讀數體積為實際溶液體積減氣泡體積,硫酸亞鐵銨標準液讀數體積減小,疊氮化鈉溶液濃度偏大,故C正確;
D選項,滴定過程中,將掛在錐形瓶壁上的硫酸亞鐵銨標準液滴用蒸餾水沖進瓶內無影響,故D錯誤;
故答案為:65%;AC;
(5)反應后溶液堿性明顯增強,且產生無色無味的無毒氣體,根據氧化還原反應得失電子守恒,則發生的離子反應為:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
故答案為:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑。


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】已知A為淡黃色固體,R是地殼中含量最多的金屬元素的單質,T為生活中使用最廣泛的金屬單質,D是具有磁性的黑色晶體,C、F是無色無味的氣體,H是白色沉淀,W溶液中滴加KSCN溶液出現血紅色。

(1)物質A的化學式為___,F化學式為___;
(2)B和R在溶液中反應生成F的離子方程式為___;
(3)H在潮濕空氣中變成M的實驗現象是___,化學方程式為___。
(4)A和水反應生成B和C的離子方程式為___,由此反應可知A有作為___的用途。
(5)M投入鹽酸中的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“碳捕捉技術”常用于去除或分離氣流中的二氧化碳。
Ⅰ.2017年,中國科學家在利用二氧化碳直接制備液體燃料領域取得了突破性進展,其中用二氧化碳制備甲醇(CH3OH)的反應如下圖:
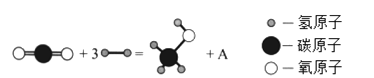
(1)A的化學式為_________。
(2)該反應說明CO2具有___________性(填“氧化”或“還原”)。若有1mol甲醇生成,轉移電子的物質的量為_________________mol。
Ⅱ.利用NaOH溶液“捕提"CO2的基本過程如下圖(部分條件及物質已略去):
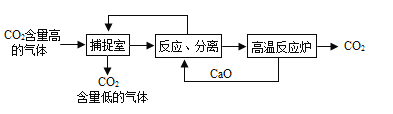
(1)反應分離室中,發生反應的化學方程式分別為CaO+H2O=Ca(OH)2和__________________
(2)高溫反應爐中,涉及反應的化學反應類型為_______________________。
(3)整個過程中,可以循環利用物質的化學式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將濃度均為0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定時間后溶液變為藍色。該實驗是一種“碘鐘實驗”。某小組同學在室溫下對該“碘鐘實驗”的原理進行探究。
(資料)
該“碘鐘實驗”的總反應:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反應分兩步進行:
反應A:H2O2+2I-+2H+=I2+2H2O
反應B:……
(1)反應B的離子方程式是______。對于總反應,I-的作用相當于______。
(2)為證明反應A、B的存在,進行實驗Ⅰ。
a.向酸化的H2O2溶液中加入試劑X的水溶液,溶液變為藍色。
b.再向得到的藍色溶液中加入Na2S2O3溶液,溶液的藍色褪去。
試劑X是______。
(3)為探究溶液變藍快慢的影響因素,進行實驗Ⅱ、實驗Ⅲ。(溶液濃度均為0.01 mol/L)
試劑 序號 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
實驗Ⅱ | 5 | 4 | 8 | 3 | 0 |
實驗Ⅲ | 5 | 2 | x | y | z |
溶液從混合時的無色變為藍色的時間:實驗Ⅱ是30 min、實驗Ⅲ是40 min。
①實驗Ⅲ中,x、y、z所對應的數值分別是______。
②對比實驗Ⅱ、實驗Ⅲ,可得出的實驗結論是______。
(4)為探究其他因素對該“碘鐘實驗”的影響,進行實驗Ⅳ。
(溶液濃度均為0.01 mol/L)
試劑 序號 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
實驗Ⅳ | 4 | 4 | 9 | 3 | 0 |
實驗過程中,溶液始終無明顯顏色變化。
試結合該“碘鐘實驗”總反應方程式及反應A與反應B速率的相對快慢關系,解釋實驗Ⅳ未產生顏色變化的原因:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數,下列說法正確的是
A.將1 L 2 mol·L-1的FeCl3溶液制成膠體后,其中含有氫氧化鐵膠粒數為2NA
B.標準狀況下,2.24L的H2O中氫原子數目大于2NA
C.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA個HSO4-
D.78gNa2O2與過量的CO2充分反應轉移電子數目為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的CO2氣體通入2L未知濃度的NaOH溶液中,在所得溶液中逐滴加入稀鹽酸至過量,并將溶液加熱,產生的氣體與HCl的物質的量的關系如圖所示(忽略氣體的溶解和HCl的揮發)下列說法正確是( )
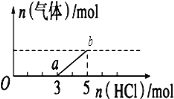
A.oa段反應的離子方程式為:H++OH-=H2O
B.O點溶液中所含溶質的化學式為NaHCO3、Na2CO3
C.標準狀況下,通入CO2的體積為4.48L
D.原NaOH溶液的物質的量濃度為2.5molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 天然氣、水煤氣、液化石油氣均是生活中常用的燃料,它們的主要成分都是化合物
B. “中國天眼”的“眼眶”是鋼鐵結成的圈梁,屬于金屬材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112號元素鎶(Cn),盛放鎶的容器上應該貼的標簽是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列敘述正確的是( )
A. 60 g甲醛和乙酸的混合物中所含碳原子數為2NA
B. 0.5mol C3H8分子中所含C-C共價鍵數為1.5NA
C. 標準狀況下,1L庚烷完全燃燒所生成的氣態產物的分子數為![]() NA
NA
D. 1mol碳正離子CH5+ 所含的電子數為11NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧是一種強氧化劑可與碘化鉀水溶液發生反應生成氧氣和單質碘。向反應后的溶液中滴入酚酞,溶液變為紅色。
(1)試寫出該反應的化學方程式(Ⅰ):_____。
(2)該反應體系中還伴隨著化學反應(Ⅱ):I2(aq) + I-(aq)![]() I3-(aq)。反應Ⅱ的平衡常數表達式為:____。
I3-(aq)。反應Ⅱ的平衡常數表達式為:____。
(3)根據如圖,計算反應Ⅱ中3-18s內用I2表示的反應速率為_____。
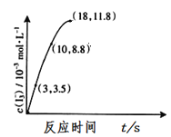
(4)為探究Fe2+對上述O3氧化I-反應的影響,將O3通入含Fe2+和I-的混合溶液中。試預測因Fe2+的存在可能引發的化學反應(請用文字描述,如:“碘離子被臭氧氧化為碘單質”)① ______。② _____;該反應的過程能顯著降低溶液的pH,并提高反應(Ⅰ)中Ⅰ-的轉化率,原因是:____ 。
(5)利用I2的氧化性可測定鋼鐵中硫的含量。做法是將鋼鐵中的硫轉化為H2SO3,然后以淀粉為指示劑,用一定濃度的I2溶液進行滴定。綜合上述各步反應及已有知識,可推知氧化性強弱關系正確的是____(填序號)。
a. Fe3+> I2 b. O3> Fe3+ c. I2> O2 d. I2>SO42-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com