
| A. | Na→NaOH→NaHCO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Fe→Fe(OH)2→FeCl2→FeCl3 | D. | Si→SiO2→H2SiO3→Na2SiO3 |
分析 A、Na$\stackrel{H_{2}O}{→}$NaOH$\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl;
B、Al2O3→Al(OH)3的轉化不能一步完成;
C、Fe→Fe(OH)2的轉化不能一步完成;
D、SiO2→H2SiO3的轉化不能一步完成.
解答 解:A、Na$\stackrel{H_{2}O}{→}$NaOH$\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl,故均可以一步完成,故A正確;
B、Al$\stackrel{O_{2}}{→}$Al2O3,Al(OH)3$\stackrel{HCl}{→}$AlCl3,但Al2O3→Al(OH)3的轉化不能一步完成,故B錯誤;
C、Fe→Fe(OH)2的轉化不能一步完成,Fe(OH)2$\stackrel{HCl}{→}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3,故C錯誤;
D、Si$\stackrel{O_{2}}{→}$SiO2,H2SiO3$\stackrel{NaOH}{→}$Na2SiO3,但SiO2→H2SiO3的轉化不能一步完成,故D錯誤.
故選A.
點評 本題考查了物質間的轉化,明確物質的性質是解本題關鍵,注意反應物相同,反應條件不同、反應物的量不同、反應物的濃度不同,產物可能不同,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 2Na十2H2O═=2NaOH十H2↑ | B. | 2H2O═2H2↑十O2↑ | ||
| C. | 2F2十2H2O═4HF十O2 | D. | SO3十H2O═H2S04 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸化學式 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物質的量濃度的各溶液pH關系為:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 將a mol•L-1 HCN溶液與a mol•L-1 NaOH溶液等體積混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| C. | 冰醋酸中逐滴加水,溶液的導電性、醋酸的電離程度、pH均先增大后減小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L四氯化碳所含分子的數目為0.5NA | |
| B. | 87g MnO2與4mol濃鹽酸共熱完全反應,能得到Cl2分子的數目為NA | |
| C. | 1mol Na2O2與足量CO2或水反應時,轉移電子的數目為NA | |
| D. | 1mol/L的NaOH溶液中含Na+數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 80g硝銨含有氮原子數為2NA | |
| B. | 1L1mol•L-1的鹽酸溶液中,所含氯化氫分子數為NA | |
| C. | 標準狀況下,11.2L四氯化碳所含分子數為0.5NA | |
| D. | 在鐵與鹽酸的反應中,鐵的化合價顯+3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
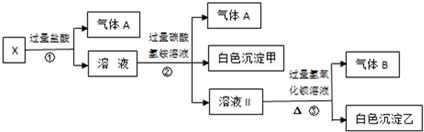
| A. | 氣體A是CO2,白色沉淀甲是氫氧化鋁 | |
| B. | 溶液中一定不含Ag+、Fe3+、SO42- | |
| C. | 溶液Ⅱ是硫酸鈉、碳酸氫銨、氯化鈉的混合物 | |
| D. | 溶液中一定存在的離子有Na+、CO32-、AlO2-和SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學事實 | 主要影響因素 | |
| (1) | 集氣瓶中有H2和Cl2的混合氣體,在瓶外點燃鎂條時發生爆炸 | |
| (2) | 黃鐵礦煅燒前,要先粉碎成細小的礦粒 | |
| (3) | 實驗室用濃鹽酸而不用稀鹽酸與MnO2反應制備氯氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com