
【題目】A—E為常見的有機物。以A為原料合成化合物E,其合成路線如圖1所示。已知:A的產量通常用來衡量一個國家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
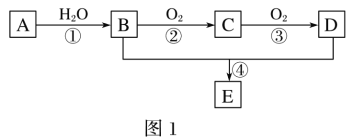
(1)A的分子式______。
(2)A中官能團的名稱是_____;B中官能團的結構簡式是_____。
(3)反應①的反應類型為_____;反應④的反應類型為_____。
(4)反應④的化學方程式為_____。
(5)某學習小組設計B催化氧化的實驗裝置如圖,根據圖2裝置回答問題。
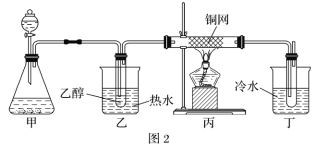
①裝置甲錐形瓶中盛放的固體為過氧化鈉,請寫出甲中反應的化學方程式_____。
②B催化氧化的產物與葡萄糖具有相同的特征反應,將所得的氧化產物滴加到新制氫氧化銅懸濁液中加熱,現象為_____。
③實驗過程中,丙裝置硬質玻璃管中發生反應的化學方程式為_____。
【答案】C2H4 碳碳雙鍵 -OH 加成反應 酯化反應(或取代反應) CH3COOH +CH3CH2OH![]() CH3COOCH2CH3 +H2O 2Na2O2+2H2O=4NaOH+O2↑ 生成磚紅色物質(沉淀) 2CH3CH2OH+O2
CH3COOCH2CH3 +H2O 2Na2O2+2H2O=4NaOH+O2↑ 生成磚紅色物質(沉淀) 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
A的產量通常用來衡量一個國家的石油化工水平,則A為乙烯,分子式為C2H4,在催化劑作用下乙烯與水發生加成反應生成乙醇,則B為乙醇,乙醇與氧氣在催化劑作用下發生氧化還原反應生成乙醛,乙醛在催化劑作用下繼續被氧氣氧化生成乙酸,乙酸和乙醇在濃硫酸加熱條件下發生酯化反應生成乙酸乙酯,則C為乙醛、D為乙酸、E為乙酸乙酯,據此分析解答(1)~ (4);
(5)在乙醇的催化氧化的實驗中,根據裝置圖可知,裝置甲用于產生氧氣,可以用雙氧水和二氧化錳,也可以用過氧化鈉和水反應,裝置乙用水浴加熱產生乙醇蒸氣,與氧氣混合,通過丙裝置中的銅網作催化劑,丁裝置用冷水冷卻得到產物,據此分析解答。
(1)根據分析,A為乙烯,分子式為C2H4;
(2)A為乙烯,結構簡式為CH2=CH2,官能團的名稱是碳碳雙鍵;B為乙醇,官能團為羥基,官能團的結構簡式是-OH;
(3)反應①為在催化劑作用下乙烯與水發生加成反應生成乙醇,反應類型為加成反應;反應④為乙酸和乙醇在濃硫酸加熱條件下發生酯化反應生成乙酸乙酯,反應類型為酯化反應(或取代反應);
(4)反應④為乙酸和乙醇在濃硫酸加熱條件下發生酯化反應生成乙酸乙酯,化學方程式為CH3COOH +CH3CH2OH![]() CH3COOCH2CH3 +H2O;
CH3COOCH2CH3 +H2O;
(5)①裝置甲錐形瓶中盛放的固體為過氧化鈉,甲中過氧化鈉與水反應生成氫氧化鈉和氧氣,反應的化學方程式2Na2O2+2H2O=4NaOH+O2↑;
②乙醇催化氧化的產物為乙醛,乙醛與葡萄糖都含有醛基,將所得的乙醛滴加到新制氫氧化銅懸濁液中加熱發生反應生成乙酸鈉、氧化亞銅和水,反應方程式為:CH3CHO+2Cu(OH)2 ![]() CH3COOH+Cu2O↓+2H2O,現象為生成磚紅色物質(沉淀);
CH3COOH+Cu2O↓+2H2O,現象為生成磚紅色物質(沉淀);
③實驗過程中,丙裝置硬質玻璃管中銅網作催化劑,乙醇在催化劑、加熱作用下被氧氣氧化成乙醛,反應的化學方程式為2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列實驗方案,不能達到相應實驗目的的是
A.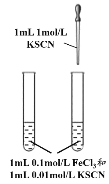 探究反應物濃度對化學平衡的影響
探究反應物濃度對化學平衡的影響
B.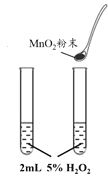 探究催化劑對反應速率的影響
探究催化劑對反應速率的影響
C.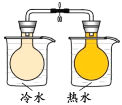 將NO2球浸泡在冷水和熱水中,探究溫度對化學平衡的影響
將NO2球浸泡在冷水和熱水中,探究溫度對化學平衡的影響
D. 比較乙醇中羥基氫原子和水分子中氫原子的活潑性
比較乙醇中羥基氫原子和水分子中氫原子的活潑性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W原子序數依次增大,X的單質是空氣中含量最高的氣體,Y的焰色反應現象為黃色。Z為金屬元素,由Z制得的容器常溫下可盛裝濃硫酸。W原子最外層比X原子最外層多2個電子。
(1)X在元素周期表中的位置為___________,X單質的結構式為___________。
(2)W的簡單氣態氫化物電子式是___________,該氣態氫化物溶于水時,破壞的化學鍵是___________。
(3)Y、Z、W的原子半徑從大到小的順序是___________(用元素符號表示)。Y的最高價氧化物的水化物和Z的最高價氧化物的水化物反應的離子方程式是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED(LightEmittingDiode)即發光二極管,是一種能夠將電能轉化為光能的固態半導體器件。如圖是某課外活動小組設計的用化學電源使LED燈發光的裝置。下列說法錯誤的是( )

A.銅片上發生的反應為2H++2e-=H2↑
B.如果將稀硫酸換成檸檬汁,則導線中不會有電子流動
C.如果將鋅片換成鐵片,則電路中的電流方向保持不變
D.裝置中存在“化學能→電能→光能”的轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴元素主要以Br-形式存在于海水(呈弱堿性)中,利用空氣吹出法從海水中提溴,工藝流程示意如圖。已知:常溫下溴呈液態,深紅棕色,易揮發。
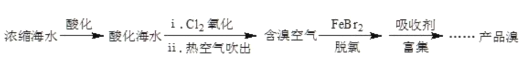
(1)氧化:請寫出i中的化學方程式_____。
(2)脫氯:除去含溴空氣中殘留的Cl2。
①具有脫氯作用的離子是_____。
②溶液失去脫氯作用后,補加FeBr2或加入_____,脫氯作用恢復。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化為BrO![]() 和Br-。再用H2SO4酸化后可以得到Br2。寫出加入H2SO4酸化生成Br2的離子方程式_____。
和Br-。再用H2SO4酸化后可以得到Br2。寫出加入H2SO4酸化生成Br2的離子方程式_____。
(4)探究NaBr溶液與H2SO4溶液反應時H2SO4濃度對生成Br2的影響,實驗如下:
序號 | A | B | C |
試劑組成 | 1mol/LNaBr 20%H2SO4 | 1mol/LNaBr 98%H2SO4 | 將B中反應后溶液用水 稀釋 |
實驗現象 | 無明顯現象 | 溶液呈棕紅色,放熱 | 溶液顏色變得很淺 |
①B中溶液呈棕紅色說明產生了_____。
②分析C中溶液顏色變淺的原因,甲同學認為是發生了化學反應所致;乙同學認為是用水稀釋所致。若認為甲同學的分析合理,請用具體的反應說明理由。若認為乙同學的分析合理,請進一步設計實驗方案證明。請從甲乙同學的說法中任選一個作答。
認為甲合理的理由_____(具體反應)。
認為乙合理的實驗方案_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉀(K)資源豐富,成本低廉,用其制作的鉀離子電池有著超越鋰離子電池的發展前景。我國科研人員在鉀離子電池的研發上做出了巨大的貢獻。如圖是我國某科研團隊研制的一種鉀離子電池充電時的示意圖,下列說法不正確的是( )

A.放電時,外電路電子由電極a流向電極b
B.鉀離子電池電解液一般選擇有機溶劑,但會有一定的安全隱患
C.充電時,每當外電路中轉移1mole-,正極材料會“釋放”39gK+
D.充電時,電極b上的電極反應式為:WS2+xK++xe-=KxWS2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下進行下列實驗,根據實驗操作和現象所得到的結論錯誤的是
選項 | 實驗操作和現象 | 結論 |
A | 向Na2SiO3溶液中通入CO2,產生白色沉淀 | 碳的非金屬性比硅的強 |
B | 向3mLKI溶液中滴加幾滴溴水,振蕩,再滴加1mL淀粉溶液,溶液顯藍色 | I-的還原性比Br-的強 |
C | 向溶液X中滴加KSCN溶液,無明顯現象,再滴加新制氯水后溶液顯紅色 | X中一定含Fe2+ |
D | 向溶液Y中滴加BaCl2溶液,出現白色沉淀,再加入足量稀鹽酸,沉淀不溶解 | Y中一定含 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】補鐵劑常用于防治缺鐵性貧血,其有效成分般為硫酸亞鐵、琥珀酸亞鐵、富馬酸亞鐵和乳酸亞鐵等。回答下列問題:
(1)能表示能量最低的亞鐵離子的電子排布式是__(填標號)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中電負性最大的原子是__,碳原子的雜化方式是__;琥珀酸亞鐵中存在配位鍵,在該配位鍵中配位原子是__,中心原子是__。
(3)富馬酸和馬來酸互為順反異構體,其電離常數如下表:
物質名稱 | Ka1 | Ka2 |
富馬酸( | 7.94×10-4 | 2.51×10-5 |
馬來酸( | 1.23×10-2 | 4.68×10-7 |
請從氫鍵的角度解釋富馬酸兩級電離常數差別較小,而馬來酸兩級電離常數差別較大的原因:__。
(4)β-硫酸亞鐵的晶胞結構如圖所示,其晶胞參數為a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占據晶胞頂點、棱心、面心和體心。在該晶胞中,硫酸根離子在空間上有__種空間取向,晶胞體內硫酸根離子的個數是__,鐵原子周圍最近的氧原子的個數為__;設阿伏加德羅常數的值為NA,則該晶體的密度是__g·cm-3(列出計算表達式)。
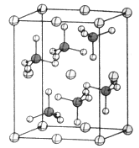
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E都是短周期元素,原子序數依次增大,A、B處于同一周期,C、D、E同處另一周期。C、B可按原子個數比2:l和1:1分別形成兩種離子化合物甲和乙。A原子的最外層電子數比次外層電子數多3個。E是地殼中含量最高的金屬元素。根據以上信息回答下列問題:
(1) D元素在周期表中的位置是___________,乙物質的電子式是___________。
(2) A、B、C、D、E五種元素的原子半徑由小到大的順序是_________(用元素符號填寫)。
(3) E的單質加入到C的最高價氧化物對應的水化物的溶液中,發生反應的離子方程式是:____________________________。
(4)簡述比較D與E金屬性強弱的實驗方法:_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com