
【題目】A、B、C、D四種元素原子的核電荷數(shù)依次增大![]() 均小于
均小于![]() ,其單質(zhì)及相應的化合物能發(fā)生如下反應關系:
,其單質(zhì)及相應的化合物能發(fā)生如下反應關系:
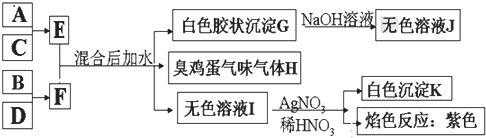
(1)寫出F的電子式 ______ 。
(2)氣體H有毒,可用![]() 溶液吸收,生成兩種酸式鹽,該反應的化學方程式為: ______ 。
溶液吸收,生成兩種酸式鹽,該反應的化學方程式為: ______ 。
(3)加熱E的水溶液后并灼燒,最終得到的固體為 ______ ,原因為 ______ 、 ______ ![]() 用化學反應方程式來表示
用化學反應方程式來表示![]() 。
。
(4)室溫下,向F的水溶液中加入等體積等濃度的鹽酸反應后所得溶液的![]() ,則此溶液中離子濃度由小到大的順序為: ______ 。
,則此溶液中離子濃度由小到大的順序為: ______ 。
(5)將氣體H放在空氣中充分燃燒可得到氣體氧化物![]() ,
,![]() 可與氧氣繼續(xù)反應:
可與氧氣繼續(xù)反應:![]() ,在一個固定容積為2L的密閉容器中充入
,在一個固定容積為2L的密閉容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分鐘后達到平衡,測得容器中含
,半分鐘后達到平衡,測得容器中含![]() 為0.18mol,則υ(O2)=______ mol/(L·min),若繼續(xù)通入
為0.18mol,則υ(O2)=______ mol/(L·min),若繼續(xù)通入![]()
![]() 和
和![]()
![]() ,再次達到新平衡后,
,再次達到新平衡后,![]() 的物質(zhì)的量介于 ______ 之間。
的物質(zhì)的量介于 ______ 之間。
(6)寫出E和F反應的化學反應方程式: ______ 。
【答案】![]()
![]()
![]()
![]() 2Al(OH)3
2Al(OH)3![]() Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+)
Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+) ![]()
![]() 和
和![]()
![]()
【解析】
A、B、C、D四種元素原子的核電荷數(shù)均小于20,G是白色膠狀沉淀,溶于氫氧化鈉溶液,G為Al(OH)3,J為NaAlO2,H為臭雞蛋氣味的氣體,H為H2S,無色溶液I與硝酸銀、硝酸反應生成白色沉淀K,K為AgCl,進行焰色反應為紫色,故I為KCl;根據(jù)E+F![]() Al(OH)3↓+H2S↑+KCl,結(jié)合原子守恒,A、B、C、D四種元素原子的核電荷數(shù)依次增大,故A為Al,B為S,C為Cl,D為K,由A+C→E可知,E為AlCl3,由B+D→F可知,F為K2S,據(jù)此分析。
Al(OH)3↓+H2S↑+KCl,結(jié)合原子守恒,A、B、C、D四種元素原子的核電荷數(shù)依次增大,故A為Al,B為S,C為Cl,D為K,由A+C→E可知,E為AlCl3,由B+D→F可知,F為K2S,據(jù)此分析。
A、B、C、D四種元素原子的核電荷數(shù)均小于20,G是白色膠狀沉淀,溶于氫氧化鈉溶液,G為Al(OH)3,J為NaAlO2,H為臭雞蛋氣味的氣體,H為H2S,無色溶液I與硝酸銀、硝酸反應生成白色沉淀K,K為AgCl,進行焰色反應為紫色,故I為KCl;根據(jù)E+F![]() Al(OH)3↓+H2S↑+KCl,結(jié)合原子守恒,A、B、C、D四種元素原子的核電荷數(shù)依次增大,故A為Al,B為S,C為Cl,D為K,由A+C→E可知,E為AlCl3,由B+D→F可知,F為K2S;
Al(OH)3↓+H2S↑+KCl,結(jié)合原子守恒,A、B、C、D四種元素原子的核電荷數(shù)依次增大,故A為Al,B為S,C為Cl,D為K,由A+C→E可知,E為AlCl3,由B+D→F可知,F為K2S;
(1)F為K2S,屬于離子化合物,由鉀離子與硫離子構(gòu)成,電子式為:![]() ;
;
(2)H2S有毒,可用Na2CO3溶液吸收,生成兩種酸式鹽,為NaHS、NaHCO3,反應方程式為:H2S+Na2CO3=NaHS+NaHCO3;
(3)E為AlCl3,AlCl3的水溶液中存在水解平衡AlCl3+3H2O Al(OH)3+3HCl,加熱AlCl3的水溶液,由于HCl的揮發(fā),促進水解得到Al(OH)3,灼燒Al(OH)3,Al(OH)3分解:2Al(OH)3![]() Al2O3+3H2O,最終得到的固體為Al2O3;
Al2O3+3H2O,最終得到的固體為Al2O3;
(4)室溫下,向K2S的水溶液中加入等體積等濃度的鹽酸,K2S與HCl物質(zhì)的量相等,發(fā)生反應K2S+HCl=KHS+KCl,混合后溶液為等濃度的KHS、KCl溶液,溶液的pH>7,則c(H+)<c(OH-),說明HS-的水解程度大于電離程度,故c(HS-)<c(Cl-),水解程度很小,故c(OH-)<c(HS-),溶液中H+來自水的電離與HS-電離,所以c(S2-)<c(H+),溶液中K+濃度最大,故溶液中離子濃度由小到大的順序為:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+);
(5)在一個固定容積為2L的密閉容器中充入0.20mol的SO2和0.10mol的O2,半分鐘后達到平衡,測得容器中含SO3為0.18mol,υ(SO3)= =0.18mol/(Lmin),速率之比等于化學計量數(shù)之比,故υ(O2 )=
=0.18mol/(Lmin),速率之比等于化學計量數(shù)之比,故υ(O2 )=![]() υ(SO3)=
υ(SO3)=![]() ×0.18mol/(Lmin)=0.09mol/(Lmin);
×0.18mol/(Lmin)=0.09mol/(Lmin);
若繼續(xù)通入0.20mol SO2和0.10mol O2,壓強增大,平衡向正反應移動,反應轉(zhuǎn)化率增大,再次達到新平衡后,SO3的物質(zhì)的量大于0.18mol×2=0.36mol,若0.4molSO2與0.2molO2完全反應,可以生成0.4molSO3,反應物不能完全轉(zhuǎn)化,故SO3小于0.4mol,即SO3的物質(zhì)的量介于0.36mol和0.40mol之間;
(6)E和F反應生成氫氧化鋁、硫化氫和氯化鉀,反應的化學反應方程式為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】已知室溫時,0.1 mol/L某一元酸HA在水中有0.1%發(fā)生電離,下列敘述錯誤的是( )
A. 該溶液的pH=4 B. 升高溫度,溶液的pH和電離平衡常數(shù)均減小
C. 此酸的電離平衡常數(shù)約為1×10-7 D. 加入少量純HA,電離程度減小電離平衡常數(shù)不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】進入冬季北方開始供暖后,霧霾天氣愈發(fā)嚴重,各地PM2.5、PM10經(jīng)常“爆表”。引發(fā)霧霾天氣的污染物中,最為常見的是機動車尾氣中的氮氧化物和燃煤產(chǎn)生的煙氣。
I、用NH3催化還原NOx可以消除氮氧化物的污染。反應原理為:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)該反應的△S________0(填“>”、“=”或“<”)。
(2)II、已知反應N2O4(g) ![]() 2NO2(g) △H,隨溫度升高,混合氣體的顏色變深。將一定量N2O4氣體充入絕熱容器一段時間后,研究壓縮和拉伸活塞過程中混合氣體的氣體的透光率(氣體顏色越淺,透光率越大)隨時間變化情況。下列說法能說明透光率不再發(fā)生改變的有________。
2NO2(g) △H,隨溫度升高,混合氣體的顏色變深。將一定量N2O4氣體充入絕熱容器一段時間后,研究壓縮和拉伸活塞過程中混合氣體的氣體的透光率(氣體顏色越淺,透光率越大)隨時間變化情況。下列說法能說明透光率不再發(fā)生改變的有________。
a.氣體顏色不再改變b.△H不再改變
c.v正(N2O4)=2v逆(NO2)d.N2O4的轉(zhuǎn)化率不再改變
(3)III、用CH4催化還原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的標準燃燒熱為-890kJ/mol,蒸發(fā)1mol H2O(l)需要吸收44kJ熱量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
寫出CH4催化還原NO2(g)生成N2和H2O(g)的熱化學方程式:________。
(4)在溫度為T1℃和T2℃時,分別將0.5mol CH4和1.2mol NO2充入體積為1L的密閉容器中,測得NO2的物質(zhì)的量隨時間變化數(shù)據(jù)如下表:
溫度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①溫度為T1℃時,0~20min內(nèi),v(CH4)=________。
②溫度為T2℃時,達平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,達新平衡時CH4的轉(zhuǎn)化率將________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pH為2的氫氟酸稀釋100倍后,pH<4。則250C時,將0.1mol·L-1的HF加水不斷稀釋,下列表示的量保持不變的是( )
①n(H+); ②c(H+)·c(OH—);③c(OH—)+ c(F—);④![]() ⑤
⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL某濃度的硫酸溶液中滴入0.1mol/L氨水,溶液中水電離的氫離子濃度隨加入氨水的體積變化如圖。下列分析正確的是( )
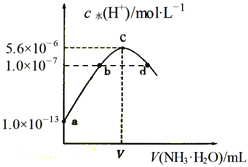
A. V=40
B. c點所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的電離常數(shù)K=10-4
D. d點所示溶液中:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定溫度和催化劑的條件下,向一密閉容器中,通入1molN2和3molH2,達到平衡狀態(tài)I;相同條件下,向另一體積相同的密閉容器中通入0.9molN2、2.7molH2和0.2molNH3,達到平衡狀態(tài)II,則下列說法正確的是
2NH3(g) △H=-92.3kJ/mol,在一定溫度和催化劑的條件下,向一密閉容器中,通入1molN2和3molH2,達到平衡狀態(tài)I;相同條件下,向另一體積相同的密閉容器中通入0.9molN2、2.7molH2和0.2molNH3,達到平衡狀態(tài)II,則下列說法正確的是
A.兩個平衡狀態(tài)的平衡常數(shù)的關系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的轉(zhuǎn)化率:平衡I<平衡Ⅱ
D.反應放出的熱量:QⅠ=QⅡ<92.3kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A(g)+B(g) ![]() C(g)+D(g)反應的平衡常數(shù)和溫度的關系如下:
C(g)+D(g)反應的平衡常數(shù)和溫度的關系如下:
溫度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常數(shù) | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列問題:
(1)該反應的平衡常數(shù)表達式K= ____________,ΔH__0(填“<”“ >”或“ =”)。
(2)830℃時,向一個5 L的密閉容器中充入0.20mol的A和0.80mol的B,如反應初始6s內(nèi)A的平均反應速率v(A)=0.003 mol·L-1·s-1,則6s時C的物質(zhì)的量為_____;則反應達到平衡時,A的轉(zhuǎn)化率為____,如果這時向該密閉容器中再充入1 mol氬氣,平衡時A的轉(zhuǎn)化率為_____(填“增大”“減少”或“不變”)。
(3)1200℃時反應C(g)+D(g) ![]() A(g)+B(g)的平衡常數(shù)的值為_______。
A(g)+B(g)的平衡常數(shù)的值為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中錯誤的是( )
A.在平衡體系PCl5(g)![]() PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段時間后37Cl存在于五氯化磷、三氯化磷和氯氣這三種物質(zhì)中
PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段時間后37Cl存在于五氯化磷、三氯化磷和氯氣這三種物質(zhì)中
B.CH3COOH與H18O-CH2CH3發(fā)生酯化反應是可逆反應,達到平衡后,18O一定僅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C.在氧氣中完全燃燒后生成物只有CO2和H2O的有機物一定是烴
D.CH2Cl2沒有同分異構(gòu)體的事實證明了甲烷分子是以碳原子為中心的正四面體結(jié)構(gòu)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對下列圖像的描述正確的是
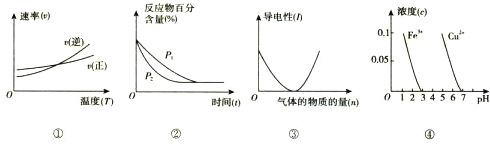
A. 根據(jù)圖①判斷反應A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 圖②可表示壓強(P)對反應2A(g)+2B(g) ![]() 3C(g)+D(s)的影響
3C(g)+D(s)的影響
C. 圖③可表示向醋酸溶液通入氨氣時,溶液導電性隨氨氣量的變化
D. 根據(jù)圖④,除去CuSO4溶液中的Fe3+,可加入CuO調(diào)節(jié)pH至3~5
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com