
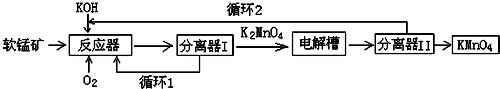
分析 軟錳礦(主要成分MnO2)為原料,通過液相法生產KMnO4.即在堿性條件下用氧氣氧化MnO2得到K2MnO4,生成的二氧化錳循環使用,分離后得到的K2MnO4,再用惰性材料為電極電解K2MnO4溶液得到KMnO4,生成的KOH循環使用,
(1)堿性條件下用氧氣氧化MnO2得到K2MnO4,根據得失電子守恒和原子守恒寫出相應的方程式;
(2)氧化鋁是兩性氧化物,氧化鋁能和強堿反應生成偏鋁酸鹽和水,所以會導致KOH消耗量偏高.
(3)在電解槽中用鉑板作用陽極,鐵作陰極電解K2MnO4溶液得到KMnO4,陰極上水得電子發生還原反應生成氫氣和氫氧根離子,陽極上錳酸根離子失電子反應氧化反應生成高錳酸根離子.
(4)根據題干信息可知反應物為K2MnO4、CO2、生成黑色固體MnO2、KMnO4,根據原子守恒書寫化學反應方程式,根據方程式可知3molK2MnO4參加反應生成2molKMnO4、1molMnO2,據此判斷氧化劑與還原劑的質量之比;電解法陽極都生成KMnO4,產率更高;
(5)發生反應:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根據方程式計算樣品中草酸的質量,進而計算草酸的質量分數.
解答 解:(1)二氧化錳和氫氧化鉀、氧氣發生反應,生成錳酸鉀和水,Mn(+4→+6),O(0→-2),反應的化學方程式為4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案為:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化鋁是兩性氧化物,既能與強酸反應也能與強堿反應,氧化鋁和強堿反應生成偏鋁酸鹽和水,反應的化學方程式為2KOH+Al2O3=2KAlO2+H2O,所以會導致KOH消耗量偏高,
故答案為:偏高;
(3)電解錳酸鉀溶液時,陰極上水得電子生成氫氣和氫氧根離子,電極反應為2H2O+2e-=H2↑+2OH-,陽極上錳酸根離子失電子生成高錳酸根離子,電極反應式為2MnO42--2e-=2MnO4-,即MnO42--e-=MnO4-,則電極總反應為:2MnO42-+2H2O$\frac{\underline{\;通電\;}}{\;}$2MnO4-+2OH-+H2↑,
故答案為:2MnO42-+2H2O$\frac{\underline{\;通電\;}}{\;}$2MnO4-+2OH-+H2↑;
(4)反應物為K2MnO4、CO2、生成黑色固體MnO2、KMnO4,所以的化學方程式為:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化學反應方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4參加反應生成2molKMnO4、1molMnO2,即3mol高錳酸鉀參與反應有1mol作氧化劑、2mol作還原劑,則反應中氧化劑與還原劑的質量比為1:2;
與該傳統工藝相比,電解法陽極都生成KMnO4,產率更高,所以優勢是產率更高、KOH循環利用;
故答案為:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;產率更高、KOH循環利用;
(5)在測定過程中,高錳酸鉀為氧化劑,草酸為還原劑,反應的離子方程式為:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根據方程式可得關系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×$\frac{100ml}{20ml}$
解得:n(H2C2O4•2H2O)=3.7×10-3mol
則m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的純度為:$\frac{0.4662g}{0.500g}$×100%=93.2%,
故答案為:93.2%.
點評 本題考查實驗制備方案的設計、物質分離與提純方法的綜合應用,題目難度中等,涉及化學實驗基本操作、工藝流程、氧化還原反應滴定計算、物質含量的測定等知識,根據題中已知條件確定生成物并寫出反應方程式明確原理是解題關鍵,是對學生綜合能力的考查.


 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:解答題
 .
. .白磷固體和W2氣體反應,生成1mol液態丙時,能量變化如圖2所示,寫出該反應的熱化學方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固體和W2氣體反應,生成固態丁時,放熱bkJ,則1mol固態丁轉化為液態丙時的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固體和W2氣體反應,生成1mol液態丙時,能量變化如圖2所示,寫出該反應的熱化學方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固體和W2氣體反應,生成固態丁時,放熱bkJ,則1mol固態丁轉化為液態丙時的△H=($\frac{1}{4}$b-a)KJ/mol.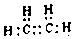 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.3 g鈉與足量丙三醇反應,轉移電子數為0.3×6.02×1023 | |
| B. | 標準狀況下,22.4 L乙醇的共價鍵數為8×6.02×1023 | |
| C. | 標準狀況下,5.6 L甲醛所含的電子數為4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的個數為0.1×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 醋酸亞鉻水合物
醋酸亞鉻水合物查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 .②中離子方程式為Br-+Ag+═AgBr↓.
.②中離子方程式為Br-+Ag+═AgBr↓. 與Br2,要想得到純凈的產物,可用NaOH溶液試劑洗滌.洗滌后分離粗產品應使用的儀器是分液漏斗.
與Br2,要想得到純凈的產物,可用NaOH溶液試劑洗滌.洗滌后分離粗產品應使用的儀器是分液漏斗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
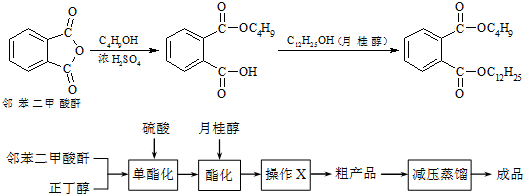
| 化合物 | 溶解性 | 熔點 | 沸點 |
| 鄰苯二甲酸酐 | 微溶于冷水、乙醚,易溶于熱苯、乙醇、乙酸 | 131.6℃ | 295℃ |
| 正丁醇 | 微溶于水,溶于乙醇、醚、多數有機溶劑 | -88.9℃ | 117.5℃ |
| 月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
| 鄰苯二甲酸丁基月桂酯 | 不溶于水,溶于多數有機溶劑 | 不祥 | 202~210℃ |
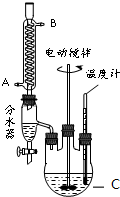
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com