
25℃時(shí),有關(guān)物質(zhì)的電離平衡常數(shù)如下:
化學(xué)式 | CH3COOH | H2CO3 | H2SO3 |
電離平衡常數(shù)K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)電解質(zhì)由強(qiáng)至弱順序?yàn)開(kāi)________________(用化學(xué)式表示,下同)。
(2)常溫下,0.02 mol·L-1的CH3COOH溶液的電離度約為 ,體積為10mLpH=2的醋酸溶液與亞硫酸溶液分別加蒸餾水稀釋至1000mL,稀釋后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列離子CH3COO-、CO32-、HSO3-、SO32-在溶 液
液 中結(jié)合H+的能力由大到小的順序?yàn)開(kāi)____________。
中結(jié)合H+的能力由大到小的順序?yàn)開(kāi)____________。
(4)NaHSO3溶液顯酸性的原因___________________________(離子方程式配適當(dāng)文字?jǐn)⑹?,其溶液中離子濃度由大到小的關(guān)系是_______________.

| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 含H+的溶液 | B. | pH=6的溶液 | ||
| C. | c(OH-)<c(H+)的溶液 | D. | 能與Al(OH)3反應(yīng)的溶液 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2016-2017學(xué)年湖南省高二上第三次月考化學(xué)卷(解析版) 題型:填空題
短周期主族元素A、B、C、D、E原子序數(shù)依次增大,A是周期表中原子半徑最小的元素,B是形成化合物種類(lèi)最多的元素,C原子的最外層電子數(shù)是次外層電子數(shù)的3倍,D是同周期中金屬性最強(qiáng)的元素,E的負(fù)一價(jià)離子與C的某種氫化物分子含有相同的電子數(shù).
(1)A、C、D形成的化合物中含有的化學(xué)鍵類(lèi)型為 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
寫(xiě)出298K時(shí),A2與E2反應(yīng)的熱化學(xué)方程式 .
(3)在某溫度下、容積均為2L的三個(gè)密閉容器中,按不同方式投入反應(yīng)物,保持恒溫恒容,使之發(fā)生反應(yīng):2A2(g)+BC(g)?X(g)△H=﹣a kJ•mol﹣1(a>0,X為A、B、C三種元素組成的一種化合物).初始投料與各容器達(dá)到平衡時(shí)的有關(guān)數(shù)據(jù)如下:
實(shí)驗(yàn) | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡時(shí)n(X) | 0.5mol | n2 | n3 |
反應(yīng)的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
體系的壓強(qiáng) | P1 | P2 | P3 |
反應(yīng)物的轉(zhuǎn)化率 | α1 | α2 | α3 |
①在該溫度下,假設(shè)甲容器從反應(yīng)開(kāi)始到平衡所需時(shí)間為4min,則A2的平均反應(yīng)速率v(A2)= .
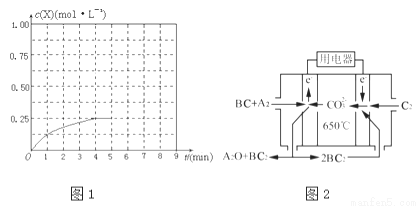
②計(jì)算該溫度下此反應(yīng)的平衡常數(shù)K= .
③三個(gè)容器中的反應(yīng)分別達(dá)平衡時(shí)各組數(shù)據(jù)關(guān)系正確的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他條件不變的情況下,將甲容器的體系體積壓縮到1L,若在第8min達(dá)到新的平衡時(shí)A2的總轉(zhuǎn)化率為75%,請(qǐng)?jiān)趫D1中畫(huà)出第5min到新平衡時(shí)X的物質(zhì)的量濃度的變化曲線.
(4)熔融碳酸鹽燃料電池(MCFC)是一種高溫燃料電池,被稱(chēng)為第二代燃料電池.目前已接近商業(yè)化,示范電站規(guī)模已達(dá)2MW,從技術(shù)發(fā)展趨勢(shì)來(lái)看,是未來(lái)民用發(fā)電的理想選擇方案之一.現(xiàn)以A2(g)、BC(g)為燃料,以一定比例Li2CO3和Na2CO3低熔混合物為電解質(zhì).寫(xiě)出碳酸鹽燃料電池(MCFC)正極電極反應(yīng)式 .
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2016-2017學(xué)年湖南省高二上第三次月考化學(xué)卷(解析版) 題型:選擇題
可逆反應(yīng)2SO2(g)+O2(g) 2SO3(g)△H<0,在一定條件下達(dá)到平衡狀態(tài),時(shí)間為t1時(shí)改變條件.化學(xué)反應(yīng)
2SO3(g)△H<0,在一定條件下達(dá)到平衡狀態(tài),時(shí)間為t1時(shí)改變條件.化學(xué)反應(yīng) 速率與反應(yīng)時(shí)間的關(guān)系如圖所示.下列說(shuō)法正確的是
速率與反應(yīng)時(shí)間的關(guān)系如圖所示.下列說(shuō)法正確的是
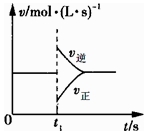
A.維持溫度、容積不變,t1時(shí)充入SO3(g)
B.維持壓強(qiáng)不變,t1時(shí)升高反應(yīng)體系溫度
C.維持溫度、容積不變,t1時(shí)充入一定量Ar
D.維持溫度、壓強(qiáng)不變,t1時(shí)充入SO3(g)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2016-2017學(xué)年湖北省高二上10月月考化學(xué)試卷(解析版) 題型:選擇題
室溫下,用0.1 mol·Lˉ 1 NaOH溶液分別滴定體積均為20mL、濃度均為0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH隨加入NaOH溶液體積變化如圖,下列說(shuō)法不正確的是
1 NaOH溶液分別滴定體積均為20mL、濃度均為0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH隨加入NaOH溶液體積變化如圖,下列說(shuō)法不正確的是
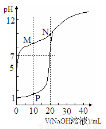
A.HX為弱酸
B.M點(diǎn)c(HX)-c(X-)﹥c(OH-)-c(H+)
C.將P點(diǎn)和N點(diǎn)的溶液混合,呈酸性
D.向N點(diǎn)的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2016-2017學(xué)年湖北省高二上10月月考化學(xué)試卷(解析版) 題型:選擇題
如圖所示,隔板I固定不動(dòng),活塞Ⅱ可自由移動(dòng),M、N兩個(gè)容器中均發(fā)生反應(yīng):A(g) +2B(g)
+2B(g) xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說(shuō)法正確的是( )
xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說(shuō)法正確的是( )

A.若x=3,達(dá)到平衡后A的體積分?jǐn)?shù)關(guān)系為:φ(M)>φ(N)
B.若x>3,達(dá)到平衡后B的轉(zhuǎn)化率關(guān)系為:α(M)>α(N)
C.若x<3,C的平衡濃度關(guān)系為:c(M)>c(N)
D.x不論為何值,起始時(shí)向N容器中充入任意值的C,平衡后N容器中A的濃度均相等
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2016-2017學(xué)年河南省高二上第一次月考化學(xué)卷(解析版) 題型:選擇題
如圖所示,下列敘述正確的是

A. Y為陰極,發(fā)生還原反應(yīng) B. X處有O2生成
C. Y與濾紙接觸處有氧氣生成 D. X與濾紙接觸處變紅
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
 甲烷作為一種新能源在化學(xué)領(lǐng)域應(yīng)用廣泛,請(qǐng)回答下列問(wèn)題:
甲烷作為一種新能源在化學(xué)領(lǐng)域應(yīng)用廣泛,請(qǐng)回答下列問(wèn)題:| 時(shí)間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com