
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .該化合物的類型是離子化合物(“離子化合物”或“共價化合物”).
.該化合物的類型是離子化合物(“離子化合物”或“共價化合物”). (填結構式).
(填結構式). 分析 由元素在元素周期表中的位置可知,①為C,②為N,③為F,④為Mg,⑤為Al,⑥為S,⑦為Cl,⑧為Ar,⑨為K,⑩為Br.
(1)能形成兩性氧化物的元素所形成的單質為Al,⑨最高價氧化物的水化物為NaOH,二者反應生成偏鋁酸鈉與氫氣;
(2)④元素與⑦元素形成的化合物為MgCl2,屬于離子化合物;
(3)同周期自左而右原子半徑減小,同主族自上而下原子半徑增大;
(4)③元素與⑩元素兩者核電荷數之差為第三周期、第四周期容納元素種數之和;
(5)用于半導體材料的元素為Si;
(6)非金屬性越強,對應氫化物越穩定.
解答 解:由元素在元素周期表中的位置可知,①為C,②為N,③為F,④為Mg,⑤為Al,⑥為S,⑦為Cl,⑧為Ar,⑨為K,⑩為Br.
(1)能形成兩性氧化物的元素所形成的單質為Al,⑨最高價氧化物的水化物為NaOH,二者反應生成偏鋁酸鈉與氫氣,反應離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)④元素與⑦元素形成的化合物為MgCl2,用電子式表示形成過程為 ,屬于離子化合物;
,屬于離子化合物;
故答案為: ;離子化合物;
;離子化合物;
(3)同周期自左而右原子半徑減小,同主族自上而下原子半徑增大,故原子半徑:F<Cl<S,故答案為:F<Cl<S;
(4)③元素與⑩元素兩者核電荷數之差為第三周期、第四周期容納元素種數之和,即二者原子序數相差8+18=26,故答案為:26;
(5)用于半導體材料的元素為Si,位于周期表中第三周期ⅣA族,故答案為:第三周期ⅣA族;
(6)非金屬N>C,非金屬性越強,對應氫化物越穩定,故NH3較穩定,其結構式為 ,故答案為:
,故答案為: .
.
點評 本題考查元素周期表與元素周期律應用,比較基礎,注意理解掌握電子式表示化學鍵或物質的形成.


 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:高中化學 來源: 題型:選擇題
| A. |  向pH=13的NaOH溶液中不斷加水稀釋 | |
| B. |  向碳酸氫鈉溶液中逐滴加入稀鹽酸至過量 | |
| C. |  將60℃接近飽和的硝酸鉀溶液恒溫蒸發水分至有白色晶體析出 | |
| D. |  將足量的金屬鎂片和鋅片分別和等質量、相同質量分數的稀硫酸混合 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
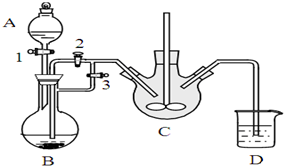 乳酸亞鐵([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:
乳酸亞鐵([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加熱或光照時,濃HNO3更易發生分解 | |
| B. | 加催化劑,使氮氣和氫氣在一定條件下轉化為氨氣 | |
| C. | 可用濃氨水和氫氧化鈉固體快速制取氨氣 | |
| D. | H2、I2、HI平衡混和氣加壓后顏色變深 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,若錐形瓶內是水,分液漏斗內的液體也是水,向燒杯內滴加水時,發現U形管內液體慢慢右移,恢復到原溫度后液面左邊與右邊基本相平,則燒杯內的物質是( )
如圖所示,若錐形瓶內是水,分液漏斗內的液體也是水,向燒杯內滴加水時,發現U形管內液體慢慢右移,恢復到原溫度后液面左邊與右邊基本相平,則燒杯內的物質是( )| A. | 過氧化鈉 | B. | 氧化鈉 | C. | 鈉 | D. | 鉀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,試管①中盛有98℃的水,試管②中充滿氣體B,將液體A滴入試管②中,充分反應后打開活塞K,發現試管①中的水立刻沸騰.則A與B可能是( )
如圖所示,試管①中盛有98℃的水,試管②中充滿氣體B,將液體A滴入試管②中,充分反應后打開活塞K,發現試管①中的水立刻沸騰.則A與B可能是( )| A. | 苯和氫氣 | B. | 稀硫酸與一氧化碳 | ||
| C. | 飽和食鹽水與氯氣 | D. | 濃溴水和乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的焓變為負值 | |
| B. | 升高溫度,逆反應速率減小 | |
| C. | 恒溫恒容下,增大壓強,H2濃度一定減小 | |
| D. | 該反應化學方程式為CO2+H2?CO+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com