
 (1)根據VSEPR模型判斷,下列微粒中所有原子都在同一平面上的一組是B.
(1)根據VSEPR模型判斷,下列微粒中所有原子都在同一平面上的一組是B.| 電離能/kJ•mol-1 | I1 | I2 |
| 銅 | 746 | 1958 |
| 鋅 | 906 | 1733 |
分析 (1)根據VSEPR模型判斷,微粒中所有原子都在同一平面上,說明該微粒為平面形結構;
(2)①a.陰陽離子間存在靜電引力和靜電斥力,則;
b.離子晶體的熔點與離子所帶電荷、離子半徑有關;
c.晶體的結構與電荷比、半徑比有關;
d.離子化合物在熔融時能發生電離;
②F-與Al3+能形成很難電離的配離子AlF63-;
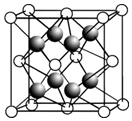
③晶胞中F-的配位數是4,與一個Ca2+等距離且最近的Ca2+個數=3×8÷2;
(3)④Cu是29號元素,其原子核外有29個電子,根據構造原理書寫基態Cu原子核外電子排布式;
⑤軌道中電子處于全滿、全空、半滿時較穩定,再失去電子需要的能量較大.
解答 解:(1)根據VSEPR模型判斷,微粒中所有原子都在同一平面上,說明該微粒為平面形結構;
A.SO32-中S原子價層電子對個數=3+$\frac{6+2-3×2}{2}$=4,為四面體結構;NO2-中N原子價層電子對個數=2+$\frac{5+1-2×2}{2}$=3,為三角錐形結構,都不是平面形結構的微粒,故A錯誤;
B.NO3-中N原子價層電子對個數=3+$\frac{5+1-3×2}{2}$=3,為平面三角形結構;
SO3中S原子價層電子對個數=3+$\frac{6-3×2}{2}$=3,為平面三角形結構,所有原子共平面,故B正確;
C.H3O+中O原子價層電子對個數=3+$\frac{6-1-3×1}{2}$=4,為四面體結構;
ClO3-中Cl原子價層電子對個數=3+$\frac{7+1-3×2}{2}$=4,為四面體結構,所有原子不共平面,故C錯誤;
D.PO43-中P原子價層電子對個數=4+$\frac{5+3-4×2}{2}$=4,為四面體結構;
SO32-中S原子價層電子對個數=3+$\frac{6+2-3×2}{2}$=4,為四面體結構,所有原子不共平面,故D錯誤;
故選B;
(2)①a.陰陽離子間存在靜電引力和靜電斥力,Ca2+與F-間存在靜電吸引作用,還存在靜電斥力,故a錯誤;
b.離子晶體的熔點與離子所帶電荷、離子半徑有關,離子半徑越小,離子晶體的熔點越高,所以CaF2的熔點高于CaCl2,故b正確;
c.晶體的結構與電荷比、半徑比有關,陰陽離子比為2:1的物質,與CaF2晶體的電荷比相同,若半徑比相差較大,則晶體構型不相同,故c錯誤;
d.CaF2中的化學鍵為離子鍵,離子化合物在熔融時能發生電離,存在自由移動的離子,能導電,因此CaF2在熔融狀態下能導電,故b正確;
故答案為:bd;
②CaF2難溶于水,但可溶于含Al3+的溶液中,因為在溶液中F-與Al3+能形成很難電離的配離子AlF63-,使CaF2的溶解平衡正移,其反應的離子方程式為:3CaF2+Al3+=3Ca2++AlF63-;
故答案為:3CaF2+Al3+=3Ca2++AlF63-;
③晶胞中F-的配位數是4,與一個Ca2+等距離且最近的Ca2+個數=3×8÷2=12;
故答案為:4; 12;
(3)④Cu是29號元素,其原子核外有29個電子,根據構造原理書寫基態Cu原子核外電子排布式為[Ar]3d104s1,
故答案為:[Ar]3d104s1;
⑤Cu原子失去一個電子后,核外電子排布為[Ar]3d10,而鋅為[Ar]3d104s1,根據洪特規則,銅達到了較穩定狀態,所以Cu的第二電離能相對較大,
故答案為:Cu原子失去一個電子后,核外電子排布為[Ar]3d10,而鋅為[Ar]3d104s1,根據洪特規則,銅達到了較穩定狀態,所以Cu的第二電離能相對較大.
點評 本題考查較綜合,涉及晶胞計算、原子核外電子排布、價層電子對互斥理論、離子晶體等知識點,側重考查學生分析、判斷、知識綜合應用、空間想象能力等,注意價層電子對互斥理論內涵、原子核外電子排布與微粒穩定性關系,題目難度不大.


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KClO3在反應中得到電子 | |
| B. | ClO2中氯的化合價為+4價 | |
| C. | 在反應中H2C2O4是還原劑 | |
| D. | 1 mol KClO3參加反應有2mol電子轉移 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
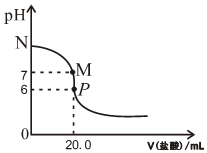 298K時,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示.
298K時,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,a L的氧氣和氮氣的混合物含有的分子數約為$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的膠體中膠粒總數小于NA個 | |
| C. | 2.3g金屬鈉變為鈉離子失去0.1NA電子 | |
| D. | 2.24L CO2中含有的原子數為3×0.1×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 步驟①中加酸,將溶液的pH 調節至2,溶液顯黃色,CrO42-離子濃度增大 | |
| B. | 步驟①中當溶液呈現深黃色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)時,說明反應2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O 達到平衡狀態 | |
| C. | 步驟②中,若要還原1 mol Cr2O${\;}_{7}^{2-}$離子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步驟③中,當將溶液的pH 調節至4 時,可認為廢水中的鉻元素已基本除盡 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
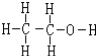 .
.| 實驗序號 | 1 | 2 | 3 |
| Na2S2O3溶液體積(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com