
【題目】下列有機化合物分子中所有的原子不可能都處于同一平面的是(
A.CF2=CF2B.HC≡CHC.C6H5—CH=CH—CHOD.CH3—O—CH3
【答案】D
【解析】
A.![]() 相當于乙烯分子中的氫原子全部替代為F原子,由于乙烯分子中所有原子共平面,所以
相當于乙烯分子中的氫原子全部替代為F原子,由于乙烯分子中所有原子共平面,所以![]() 中所有原子一定共平面,A項不符合題意不選;
中所有原子一定共平面,A項不符合題意不選;
B.![]() 中所有原子在同一條直線上,因此也一定在同一平面內,B項不符合題意不選;
中所有原子在同一條直線上,因此也一定在同一平面內,B項不符合題意不選;
C.![]() 相當于乙烯分子中的一個氫原子被替代為苯基,還有一個氫原子被替代為醛基;由于苯的所有原子共平面,苯基又是通過單鍵與碳碳雙鍵相連,所以苯基與碳碳雙鍵也可能共平面;醛基中的三個原子共平面,醛基又是通過單鍵與碳碳雙鍵相連,所以醛基與碳碳雙鍵也可能共平面;綜上所述,
相當于乙烯分子中的一個氫原子被替代為苯基,還有一個氫原子被替代為醛基;由于苯的所有原子共平面,苯基又是通過單鍵與碳碳雙鍵相連,所以苯基與碳碳雙鍵也可能共平面;醛基中的三個原子共平面,醛基又是通過單鍵與碳碳雙鍵相連,所以醛基與碳碳雙鍵也可能共平面;綜上所述,![]() 中的所有原子可能共平面,C項不符合題意不選;
中的所有原子可能共平面,C項不符合題意不選;
D.![]() 中的C形成的都是四條單鍵,單鍵鍵角約為109°28′,與這種C原子相連的所有原子一定不會在同一平面內,因此
中的C形成的都是四條單鍵,單鍵鍵角約為109°28′,與這種C原子相連的所有原子一定不會在同一平面內,因此![]() 中的所有原子一定不會共平面,D項符合題意;
中的所有原子一定不會共平面,D項符合題意;
答案選D。


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:
【題目】33.6g 含雜質的Na2CO3、NaHCO3均勻混合物平均分成兩份,向一份中加入250ml 1.00mol·L-1過量鹽酸反應,生成標準狀況下3.36L氣體。將另一份充分灼燒,干燥后稱得固體質量為13.7g。雜質不與酸反應,受熱也不分解。求:
(1)原混合物中含有Na2CO3的物質的量。
(2)Na2CO3、NaHCO3的質量比。(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,![]() 比
比![]() 少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為
少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為![]() ,且其核內質子數等子中子數.R是由A、D兩元素形成的離子化合物,其中
,且其核內質子數等子中子數.R是由A、D兩元素形成的離子化合物,其中![]() 與
與![]() 離子數之比為2:1。請回答下列問題:
離子數之比為2:1。請回答下列問題:
(1)![]() 形成的晶體屬于______
形成的晶體屬于______![]() 填寫離子、分子、原子
填寫離子、分子、原子![]() 晶體.
晶體.
(2)![]() 的電子排布式為______,在
的電子排布式為______,在![]() 分子中C元素原子的原子軌道發生的是______雜化,
分子中C元素原子的原子軌道發生的是______雜化,![]() 分子的VSEPR模型為______.
分子的VSEPR模型為______.
(3)![]() 的氫化物在水中的溶解度特別大,原因______
的氫化物在水中的溶解度特別大,原因______
(4)![]() 元素與同周期相鄰元素的第一電離能由大到小的關系是:______
元素與同周期相鄰元素的第一電離能由大到小的關系是:______![]() 用元素符號表示
用元素符號表示![]() ;用一個化學方程式說明B、D兩元素形成的單質的氧化性強弱:______.
;用一個化學方程式說明B、D兩元素形成的單質的氧化性強弱:______.
(5)已知下列數據:
![]()
![]()
由![]() 和
和![]() 反應生成CuO的熱化學方程式是______.
反應生成CuO的熱化學方程式是______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列不能用勒沙特列原理解釋的是
A.實驗室用排飽和食鹽水的方法收集![]()
B.硫酸工業中,使用過量的空氣以提高二氧化硫的轉化率
C.合成氨工業中,及時液化分離![]() ,并循環利用未反應完的
,并循環利用未反應完的![]() 和
和![]()
D.合成氨工業中,500℃比常溫更有利于氨的合成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知0.1 mol·L-1的氫氟酸溶液中存在電離平衡:HF![]() F-+H+,要使溶液中
F-+H+,要使溶液中![]() 的值增大,可以采取的措施是( )
的值增大,可以采取的措施是( )
①加少量燒堿溶液 ②升高溫度 ③通入少量HF氣體 ④加水
A.①②B.①③C.②④D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酰氯![]() 可用作殺蟲劑,通常條件下為無色液體,熔點為
可用作殺蟲劑,通常條件下為無色液體,熔點為![]() ,沸點為
,沸點為![]() 。在潮濕空氣中“發煙”;
。在潮濕空氣中“發煙”;![]() 以上開始分解,生成二氧化硫和氯氣,長期放置也可分解,制備時以活性炭為催化劑,反應的熱化學方程式為
以上開始分解,生成二氧化硫和氯氣,長期放置也可分解,制備時以活性炭為催化劑,反應的熱化學方程式為![]()
![]() ,所用裝置如圖所示。下列敘述錯誤的是
,所用裝置如圖所示。下列敘述錯誤的是![]()
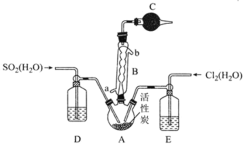
A.球形冷凝管B應從a口進水b口出水
B.可通過觀察D和E中氣泡產生速率控制通入A中的![]() 和
和![]() 的體積比
的體積比
C.儀器C,D,E中盛放的試劑依次為無水氯化鈣、濃硫酸、濃硫酸
D.長期放置的硫酰氯液體會發黃的原因是溶解了氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中的一定量混合氣體發生反應xM (g)+yN(g)![]() zP(g)。平衡時測得M的濃度為0.80 mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得M的濃度降低為0.50 mol/L。下列有關判斷正確的是
zP(g)。平衡時測得M的濃度為0.80 mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得M的濃度降低為0.50 mol/L。下列有關判斷正確的是
A.x + y < zB.平衡向正反應方向移動
C.N的轉化率降低D.混合氣體的密度不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力I隨加入水的體積V變化的曲線如圖所示。請回答:
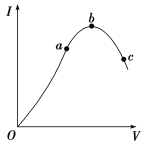
(1)“O”點導電能力為0的理由是_________________________。
(2)寫出醋酸的電離方程式___________________________________________。
(3)a、b、c三點溶液中氫離子濃度由小到大的順序為__________________ 。
(4)a、b、c三點處,電離程度最大的是________。
(5)醋酸與氨水反應的離子方程式:__________________ 。
(6)寫出醋酸電離平衡常數表達式:_______________;
(7)向0.1mol/L 醋酸溶液中加入水,電離平衡向_______移動 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(CH3COOH)_______(填“增大”、“減小”或“不變”);
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 鹽酸溶液b與足量Zn粉反應,初始速率a___b;生成H2的量a____b;完全中和這兩種酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉![]() 是一種高效的漂白劑和消毒劑,它在酸性條件下生成NaCl并放出
是一種高效的漂白劑和消毒劑,它在酸性條件下生成NaCl并放出![]() ,
,![]() 有類似
有類似![]() 的性質。某興趣小組探究亞氯酸鈉的制備與性質。
的性質。某興趣小組探究亞氯酸鈉的制備與性質。
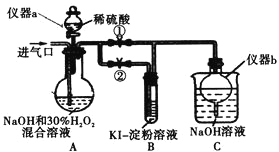
(I)制備亞氯酸鈉
關閉止水夾![]() ,打開止水夾
,打開止水夾![]() ,從進氣口通入足量
,從進氣口通入足量![]() ,充分反應。
,充分反應。
(1)儀器a的名稱為_________,儀器b的作用是_________。
(2)裝置A中生成![]() 的化學方程式為_________。
的化學方程式為_________。
(3)若從裝置A反應后的溶液中獲得![]() 晶體,則主要操作有:減壓蒸發濃縮、________、過濾、洗滌、干燥等。
晶體,則主要操作有:減壓蒸發濃縮、________、過濾、洗滌、干燥等。
(II)探究亞氯酸鈉的性質
停止通![]() 氣體,再通入空氣一段時間后,關閉止水夾
氣體,再通入空氣一段時間后,關閉止水夾![]() ,打開止水夾
,打開止水夾![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)請寫出這時A中發生反應的離子方程式_________。
(5)開始時A中反應緩慢,稍后產生氣體的速率急劇加快,請解釋可能的原因_________。
(6)B中現象為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com