
科目:高中化學 來源: 題型:解答題
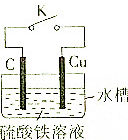 某同學為了探究原電池原理,設計如圖所示裝置:
某同學為了探究原電池原理,設計如圖所示裝置:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的準確濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:
某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的準確濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:| 指示劑 | 甲基橙 | 甲基紅 | 石蕊 | 酚酞 |
| 變色范圍(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液體積/mL | 21.02 | 20.32 | 20.28 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | V(NaOH)=0時,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL時,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL時,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL時,c(Na+)>c(C2O42-)>c(HC2O4- ) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
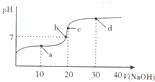 室溫時,向20mL0.1mol•L-1的醋酸溶液中不斷滴人0.1mol•L-1的NaOH溶液,溶液的pH變化曲線如圖所示.在滴定過程中,關于溶液中離子濃度大小關系的描述不正確的是( )
室溫時,向20mL0.1mol•L-1的醋酸溶液中不斷滴人0.1mol•L-1的NaOH溶液,溶液的pH變化曲線如圖所示.在滴定過程中,關于溶液中離子濃度大小關系的描述不正確的是( )| A. | a點時:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b點時:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c點時:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d點時:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗編號 | HA的物質的量 濃度(mol•L-1) | NaOH的物質的量 濃度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | 最外層電子占核外電子總數的$\frac{3}{8}$ |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 元素最高正價是+7價 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com