碳及其化合物有廣泛的用途.
(1)將水蒸氣通過紅熱的碳即可產生水煤氣.反應為:
C(s)+H
2O(g)?CO(g)+H
2(g)△H=+131.3kJ?mol
-1,以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H
2O的平衡轉化率的是
.(填序號)
A.升高溫度 B.增加碳的用量 C.加入催化劑 D.用CO吸收劑除去CO
(2)又知,C(s)+CO
2(g)?2CO(g)△H=+172.5kJ?mol
-1,則CO(g)+H
2O(g)?CO
2(g)+H
2(g)的焓變△H=
.
(3)CO與H
2在一定條件下可反應生成甲醇,CO(g)+2H
2(g)?CH
3OH(g).甲醇是一種燃料,可利用甲醇設計一個燃料電池,用稀硫酸作電解質溶液,多孔石墨做電極,該電池負極反應式為:
.
若用該電池提供的電能電解60mL NaCl溶液,設有0.01molCH
3OH完全放電,NaCl足量,且電解產生的Cl
2全部溢出,電解前后忽略溶液體積的變化,則電解結束后所得溶液的pH=
.
(4)將一定量的CO(g)和H
2O(g)分別通入到體積為2.0L的恒容密閉容器中,發生以下反應:
CO(g)+H
2O(g)?CO
2(g)+H
2(g),得到如下數據:
| 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所x需時間/min |
| H2O | CO | H2 | CO | |
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通過計算求出該反應的平衡常數(結果保留兩位有效數字)
.
改變反應的某一條件,反應進行到t min時,測得混合氣體中CO
2的物質的量為0.6mol.若用200mL 5mol/L的NaOH溶液將其完全吸收,反應的離子方程式為(用一個離子方程式表示)
.
(5)工業生產是把水煤氣中的混合氣體經過處理后獲得的較純H
2用于合成氨.合成氨反應原理為:N
2(g)+3H
2(g)
2NH
3(g)△H=-92.4kJ?mol
-1.實驗室模擬化工生產,分別在不同實驗條件下反應,N
2濃度隨時間變化如圖.
不同實驗條件下反應,N
2濃度隨時間變化如圖1.
請回答下列問題:
①與實驗Ⅰ比較,實驗Ⅱ改變的條件為
.
②實驗Ⅲ比實驗Ⅰ的溫度要高,其它條件相同,請在上圖2中畫出實驗Ⅰ和實驗Ⅲ中NH
3濃度隨時間變化的示意圖.





 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案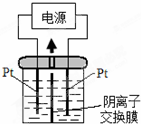 電解裝置如圖,電解槽內裝有KI及淀粉溶液,中間用陰離子交換膜隔開.在一定的電壓下通電,發現左側溶液變藍色,一段時間后,藍色逐漸變淺.已知:3I2+6OH-=IO3-+5I-+3H2O,下列說法正確的是( )
電解裝置如圖,電解槽內裝有KI及淀粉溶液,中間用陰離子交換膜隔開.在一定的電壓下通電,發現左側溶液變藍色,一段時間后,藍色逐漸變淺.已知:3I2+6OH-=IO3-+5I-+3H2O,下列說法正確的是( )
 如圖是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6種元素的代號.
如圖是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6種元素的代號.


