
【題目】某研究小組利用軟錳礦(主要成分為![]() ,另含少量鐵,鋁,銅等金屬化合物)作脫硫劑,通過如下簡化流程,既脫除燃煤尾氣中的
,另含少量鐵,鋁,銅等金屬化合物)作脫硫劑,通過如下簡化流程,既脫除燃煤尾氣中的![]() ,又制得電池材料
,又制得電池材料![]() (反應條件已省略).請回答下列問題:
(反應條件已省略).請回答下列問題:

(1)上述流程脫硫實現了________(填編號).
a.廢棄物的綜合利用 b.“白色污染”的減少
c.酸雨的減少 d.臭氧層空洞的減小
(2)已知:25℃,101kPa時,![]()
![]() ,
,![]()
![]() ,
,![]()
![]() 。則步驟Ⅰ中
。則步驟Ⅰ中![]() 與
與![]() 反應生成無水
反應生成無水![]() 的熱化學方程式是__________。
的熱化學方程式是__________。
(3)用離子方程式表示出步驟Ⅱ中用![]() 除去
除去![]() 的反應原理:__________。
的反應原理:__________。
(4)已知![]() ;在步驟Ⅲ除銅鎳的過程中,當
;在步驟Ⅲ除銅鎳的過程中,當![]() 恰好完全沉淀[此時溶液中
恰好完全沉淀[此時溶液中![]() ],則溶液中
],則溶液中![]() 的濃度是_________mol/L。
的濃度是_________mol/L。
(5)步驟Ⅳ生成無水![]() 的化學方程式是___________。
的化學方程式是___________。
(6)產品![]() 可作超級電容材料.用惰性電極電解
可作超級電容材料.用惰性電極電解![]() 溶液可以制得
溶液可以制得![]() ,其陽極的電極反應式是________________________。
,其陽極的電極反應式是________________________。
(7)已知廢氣中![]() 濃度為
濃度為![]() ,軟錳礦漿對
,軟錳礦漿對![]() 的吸收率可達90%,則處理
的吸收率可達90%,則處理![]() 燃煤尾氣,可得到硫酸錳晶體(
燃煤尾氣,可得到硫酸錳晶體(![]() ,相對分子質量為169)的質量為_____kg(結果保留3位有效數字)。
,相對分子質量為169)的質量為_____kg(結果保留3位有效數字)。
【答案】ac SO2(g)+MnO2(s)=MnSO4(s) ΔH=-248 kJ/mol 3MnCO3+2Al3++3H2O=3Mn2++3CO2↑+2Al(OH)3↓ ![]() 2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4 Mn2++2H2O-2e-=MnO2+4H+ 1.90
2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4 Mn2++2H2O-2e-=MnO2+4H+ 1.90
【解析】
(1)SO2對大氣污染的主要危害是產生了酸雨,所以該脫硫過程實現了SO2變廢為寶和減少酸雨的發生;答案選ac;
(2)將題中所給方程式依次記作①、②、③,由方程式③-①-②可得:SO2(g)+MnO2(s)=MnSO4(s),根據蓋斯定律可算出該反應的反應熱ΔH=(-1 065 kJ/mol)-(-520 kJ/mol)-(-297 kJ/mol)=-248 kJ/mol,所以該反應的熱化學方程式為SO2(g)+MnO2(s)=MnSO4(s) ΔH=-248 kJ/mol;
(3)步驟Ⅱ是用MnCO3調節溶液pH使Al3+轉化為Al(OH)3沉淀而除去:3MnCO3+2Al3++3H2O=3Mn2++3CO2↑+2Al(OH)3↓;
(4)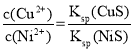 =6×10-21,所以c(Cu2+)=6×10-21×1.0×10-5 mol/L=6.0×10-26 mol/L;
=6×10-21,所以c(Cu2+)=6×10-21×1.0×10-5 mol/L=6.0×10-26 mol/L;
(5)發生氧化還原反應,氧化劑是KMnO4、還原劑是MnSO4、氧化產物和還原產物都是MnO2,由得失電子數相等可知:3n(KMnO4)=2n(MnSO4),最后再由質量守恒配平得:2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4;
(6)陽極是Mn2+失去電子發生氧化反應生成MnO2:Mn2++2H2O-2e-=MnO2+4H+;
(7)由硫元素質量守恒知n(SO2)=n(MnSO4·H2O),所以m(MnSO4·H2O)=100×8×0.9/64×169 g=1901.25g=1.90 kg。


科目:高中化學 來源: 題型:
【題目】某恒定溫度下,在一個2L的密閉容器中,加入4 mol A和2 mol B進行如下反應:3A (g)+2B (g)4C (?)+2D (?),“?”代表狀態不確定。反應一段時間后達到平衡,測得生成 1.6 mol C,且反應前后壓強之比為5:4,則下列說法正確的是
A.增加C,B的平衡轉化率不變
B.此時B的平衡轉化率是35%
C.增大該體系的壓強,平衡向右移動,化學平衡常數增大
D.該反應的化學平衡常數表達式是K=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸雨的主要成分是H2SO4,以下是形成途徑之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下敘述錯誤的是
A. NO2由反應N2+2O2![]() 2NO2生成
2NO2生成
B. 總反應可表示為2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 還可能發生的反應有4NO2+O2+2H2O=4HNO3
D. 還可能發生的反應有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯水中含有多種成分,因而具有多種性質,根據氯水分別與圖中四種物質發生的反應填空(a、b、c、d重合部分代表物質間反應,且氯水足量)。
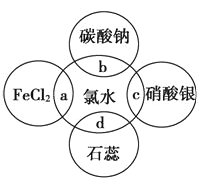
(1)能證明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c過程中的現象是________________,b過程中反應的離子方程式為________________。
(3)a過程中反應的化學方程式為____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組用如圖裝置進行SO2與FeCl3溶液反應的相關實驗(夾持裝置已略去)。

(1)在配制氯化鐵溶液時,需先把氯化鐵晶體溶解在________中,再加水稀釋,這樣操作的目的是________,操作中不需要的儀器有________(填入正確選項前的字母)。
a.藥匙 b.燒杯 c.石棉網 d.玻璃棒 e.坩堝
(2)通入足量SO2時,C中觀察到的現象為______________________________。
(3)根據以上現象,該小組同學認為SO2與FeCl3溶液發生了氧化還原反應。
①寫出SO2與FeCl3溶液反應的離子方程式:___________________________;
②請設計實驗方案檢驗有Fe2+生成:__________________________________;
③該小組同學向C試管反應后的溶液中加入硝酸酸化的BaCl2溶液,若出現白色沉淀,即可證明反應生成了SO42-。該做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D裝置中倒置漏斗的作用是______________________________________。
(5)為了驗證SO2具有還原性,實驗中可以代替FeCl3的試劑有________(填入正確選項前的字母)。
a.濃H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對化學平衡移動的分析中,不正確的是
①已達平衡的反應C(s)+H2O(g)![]() CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動 ②已達平衡的反應N2(g)+3H2(g)
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動 ②已達平衡的反應N2(g)+3H2(g)![]() 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高 ③有氣體參加的反應達到平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動 ④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高 ③有氣體參加的反應達到平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動 ④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯化氧磷(POCl3)是一種重要的化工原料,常用作半導體摻雜劑,實驗室制取POCl3并測定產品含量的實驗過程如下:
I.制備POCl3采用氧氣氧化液態的PCl3法。實驗裝置(加熱及夾持裝置省略》及相關信息如下。
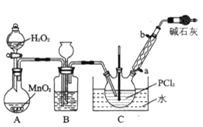
物質 | 熔點/℃ | 沸點/℃ | 相對分子質量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均為無色液體,遇水均劇烈 水解為含氧酸和氯化氫,兩者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)儀器a的名稱為_______________________________;
(2)裝置C中生成POCl3的化學方程式為________________________________;
(3)實驗中需控制通入O2的速率,對此采取的操作是_________________________________;
(4)裝置B的作用除觀察O2的流速之外,還有___________________________________;
(5)反應溫度應控制在60~65℃,原因是__________________________________;
II.測定POCl3產品含量的實驗步驟:
①實驗I結束后,待三頸燒瓶中液體冷卻到室溫,準確稱取16.725g POCl3產品,置于盛有60.00 mL蒸餾水的水解瓶中搖動至完全水解,將水解液配成100.00mL溶液
②取10.00mL溶液于錐形瓶中,加入10.00mL 3.5mol/L AgNO3標準溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且難溶于水)
④以硫酸鐵溶液為指示劑,用0.2mol/L KSCN溶液滴定過量的AgNO3溶液(Ag++SCN-=AgSCN↓),到達終點時共用去10.00mL KSCN溶液。
(6)達到終點時的現象是_________________________________________;
(7)測得產品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),據此判斷,若取消步驟③,滴定結果將_______。(填偏高,偏低,或不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某透明溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干種離子,某興趣小組進行了如下實驗.其中氣體1在空氣中能變為紅棕色.
中的若干種離子,某興趣小組進行了如下實驗.其中氣體1在空氣中能變為紅棕色.

上述反應中沒有生成的氣體是( )
A.NOB.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有效去除廢水中的H2SiF6、F-,改善水質是環境部門的重要研究課題。
(1)AlF3是有機合成中常用催化劑,利用廢水中的H2SiF6可轉變制得,相關熱化學方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
則反應H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=___kJ·mol-1。
(2)廢水的酸堿度及廢水中的Fe3+對F-濃度的測定都會產生一定的影響。
①測定時,通常控制廢水的pH在5~6之間。pH過小所測F-濃度偏低,其原因是___。
②Fe3+與檸檬酸根(C6F5O73-)、F-反應可表示為Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟廢水中加入檸檬酸鈉(C6H5O7Na3)可消除Fe3+對F-測定的干擾,其原因是___。
FeFn(3-n)。向含有Fe3+的含氟廢水中加入檸檬酸鈉(C6H5O7Na3)可消除Fe3+對F-測定的干擾,其原因是___。
(3)利用聚苯胺可吸附去除水中F-。用惰性電極電解苯胺(![]() )和鹽酸的混合液可在陽極獲得聚苯胺薄膜,變化過程為:
)和鹽酸的混合液可在陽極獲得聚苯胺薄膜,變化過程為:
![]()
寫出陽極生成二聚體的電極反應式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除廢水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]為原料可制得MgCO3,寫出該反應的化學方程式:___。
②取三份相同的含F-的酸性廢水,分別加入足量的MgCO3、Ca(OH)2和CaCO3。相同時間后溶液的pH及F-殘留量如圖1所示。實際廢水處理過程中常選用MgCO3的優點除了F-殘留率比較低之外,還有___。
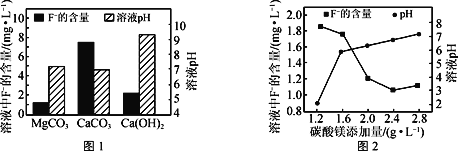
③改變碳酸鎂添加量,處理后廢水中F-含量及溶液pH的變化如圖2所示。添加量超過2.4g·L-1后,溶液pH增大,使少量MgF2轉化為Mg(OH)2,F-含量略有升高,此時溶液中的![]() =___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
=___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com