
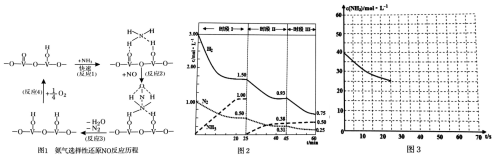
分析 (1)用V2O5作催化劑,NH3可將NO還原成N2,結合反應歷程圖可知反應物還有氧氣,生成物為N2和H2O,配平即得反應方程式;
(2)①根據v=$\frac{△c}{△t}$計算出前20min內氨氣的平均反應速率v(NH3),根據達到平衡時生成氨氣的物質的量及熱化學方程式N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1計算出放出的熱量;
②根據25min時氨氣的物質的量變為0,而氮氣和氫氣的物質的量不變進行解答,改變的條件是分離出氨氣;
③根據時段Ⅲ條件下達到平衡時各組分的濃度及平衡常數等于生成物平衡濃度冪次方乘積除以反應物平衡濃度冪次方乘積進行解答;
(3)催化劑改變反應速率不改變化學平衡,依據催化劑的作用畫出圖象.
解答 解:(1)用V2O5作催化劑,NH3可將NO還原成N2,結合反應歷程圖可知反應物還有氧氣,生成物為N2和H2O,配平即得反應方程式為4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O,
故答案為:4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O;
(2)①根據圖象可知,20min時氨氣的物質的量濃度為1.00mol/L,所以氨氣的平均反應速率為:v(NH3)=$\frac{1.00mol/L}{20min}$=0.050mol(L•min)-1;
達到平衡時生成的氨氣的物質的量為:1.00 mol/L×1L=1.00mol,
根據N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨氣放出的熱量為94.4kJ,
故答案為:0.050mol(L•min)-1; 94.4kJ;
②25min時氨氣的物質的量迅速變為0而氮氣、氫氣的物質的量不變,之后氮氣、氫氣的物質的量逐漸減小,氨氣的物質的量逐漸增大,說明25min時改變的條件是將NH3從反應體系中分離出去,
故答案為:將NH3從反應體系中分離出去;
③時段Ⅲ條件下,反應為:N2(g)+3H2(g)?2NH3(g),圖象方向可知平衡狀態下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,該反應的化學平衡常數為:K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})c({N}_{2})}$=$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$,
故答案為:$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g),反應進行到40s時達到平衡,反應達到平衡時CO2的轉化率為50%,消耗二氧化碳濃度20mol/L×50%=10mol/L;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 40 20 0 0
變化量(mol/L) 20 10 0 10
平衡量(mol/L) 20 10 0 10
若反應延續至70s,保持其它條件不變情況下,使用催化劑時,改變反應速率,不改變化學平衡,曲線的轉折點在橫坐標40之前,縱坐標必需在20的線上,該反應的進程曲線為如圖所示: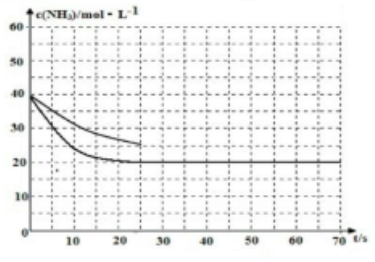 ,
,
故答案為: .
.
點評 本題考查較為綜合,涉及化學平衡影響因素分析、化學平衡的計算等知識,題目難度中等,注意掌握化學平衡及其影響因素,試題培養了學生的分析能力及靈活應用能力.


 學而優暑期銜接南京大學出版社系列答案
學而優暑期銜接南京大學出版社系列答案 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 試劑(必要時可加熱 | 物質 |
| A | 硝酸銀溶液 | 氯化鈉溶液和碳酸鈉溶液 |
| B | 氯氣 | 硫酸亞鐵溶液和FeCl2溶液 |
| C | MnO2 | 濃鹽酸和稀硫酸 |
| D | 紫色石蕊試劑 | 次氯酸鈣和次氯酸鈉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
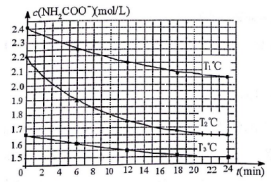 工業上合成尿素(H2NCONH2)分為兩步:
工業上合成尿素(H2NCONH2)分為兩步:| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量之比為1:1 | B. | 密度之比為4:11 | ||
| C. | 體積之比為4:11 | D. | 原子數之比為5:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯、苯和乙酸均能發生加成反應 | |
| B. | 某芳香烴的分子式為C10H14,它可使酸性 KMnO4溶液褪色,且分子結構中只有一個側鏈,符合條件的烴有4種 | |
| C. | 1 mol的有機物(結構如圖)最多能與含5mol NaOH的水溶液完全反應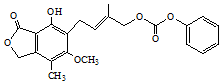 | |
| D. | 油脂皂化反應得到高級脂肪酸與甘油 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | n(HCl)<n(NH3•H2O) | B. | 鹽酸過量 | C. | 恰好中和 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 負極反應式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 電池工作時,CH3OH發生還原反應,被氧化 | |
| C. | 電池工作時,溶液中的陰離子向負極移動 | |
| D. | 電池工作一段時間后,溶液的pH增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①中水銀“積變又還成丹砂”說明水銀發生了還原反應 | |
| B. | ②中反應的離子方程式為:2Fe+3Cu2+=2Fe3++3Cu | |
| C. | 根據①可知溫度計打破后可以用硫粉覆蓋水銀,防止中毒 | |
| D. | 水銀能跟曾青發生置換反應生成單質銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 小明同學在總結酸、堿、鹽之間的相互反應關系時發現,選用適當物質既可實現如圖中所示的所有反應.若中間的物質為硫酸鋇,那么對酸、堿、甲鹽、乙鹽四種物質的推斷中,合理的是( )
小明同學在總結酸、堿、鹽之間的相互反應關系時發現,選用適當物質既可實現如圖中所示的所有反應.若中間的物質為硫酸鋇,那么對酸、堿、甲鹽、乙鹽四種物質的推斷中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com