
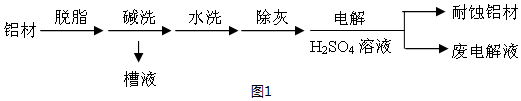
分析 (1)①有氣泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因堿洗槽液中有AlO2-,故應通入CO2來回收Al(OH)3,發生反應2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀還會繼續溶解;
②鋁為陽極,會發生氧化反應,表面形成氧化膜,必須有水參加,所以電極反應式為:2Al+3H2O-6e-═Al2O3+6H+;HCO3-與H+反應使H+濃度減小,產生Al(OH)3沉淀;
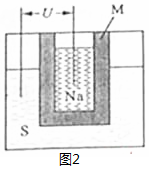
(2)①原電池正極發生得電子的還原反應,結合原電池的構成條件和題意實際情況來分析M的作用,根據鉛蓄電池的工作原理和鈉硫高能電池的工作原理來回答;
②根據鹽的電離和離子的水解知識來比較離子濃度大小,根據加入硫酸銅后所發生的反應情況來判斷pH的變化,根據硫離子的強還原性來回答.
解答 解:(1)①鋁能與強堿反應產生氫氣,Al(OH)3具有兩性,既能與強堿反應也能與強酸反應生成鹽和水,堿洗槽液中有AlO2-,故應通入CO2來回收Al(OH)3,發生反應2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀還會繼續溶解,
故答案為:2Al+2OH-+2H2O═2AlO2-+3H2↑;b;
②鋁為陽極,會發生氧化反應,表面形成氧化膜,必須有水參加,所以電極反應式為:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后產生氣泡和白色沉淀,是由于廢電解液中含有Al3+,和HCO3-發生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-與H+反應使H+濃度減小,產生Al(OH)3沉淀,
故答案為:2Al+3H2O-6e-═Al2O3+6H+;因為Al3+和HCO3-發生了雙水解,Al3++3HCO3-═Al(OH)3↓+CO2↑;
(2)①原電池正極發生得電子的還原反應,在反應2Na+xS=Na2Sx中,硫單質得電子,故正極反應為:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx),M作為電解質的同時又將鈉和硫隔開,與鉛蓄電池相比,當消耗相同質量的負極活性物質鉛和鈉時,鉛成為鉛離子時轉移電子的物質的量是鈉成為鈉離子時轉移的電子的物質的量的4.5倍,即鈉硫電池的理論放電量是鉛蓄電池4.5倍,故答案為:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx)、離子導電(導電或電解質)和隔離鈉與硫、4.5;
②硫化鈉電離出的離子有鈉離子和硫離子,理論上鈉離子濃度是硫離子的2倍,故c(Na+)>c(S2-),但少量的硫離子水解,第一步水解強于第二步,兩步水解均生成氫氧根,故c(S2-)>c(OH-)>c(HS-),溶液顯堿性,故氫離子濃度最小,加硫酸銅后,溶液由堿性硫化鈉溶液變為中性硫酸鈉溶液,故pH 減小,
硫離子有很強還原性,很容易被空氣氧化,反應方程式為:2S2-+O2+2H2O=2S↓+4OH-,
故答案為:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);減小;2S2-+O2+2H2O=2S↓+4OH-.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備流程中的反應及混合物分離方法為解答的關鍵,注意氧化還原反應、電化學反應原理的應用,綜合性較強,題目難度中等.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | NA個氫分子與NA個氧分子的質量比為1:1 | |
| B. | 1 mol氫氣的質量與NA個氫分子的質量相等 | |
| C. | 16g氧氣中含有的氧原子數為NA | |
| D. | 44g CO2與28g CO所含有的分子數均為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeSO4 (CuSO4):加足量鐵粉后,過濾 | |
| B. | CO (CO2):用NaOH溶液洗氣后干燥 | |
| C. | CO2 (HCl):用NaOH溶液洗氣后干燥 | |
| D. | MnO2 (KCl):加水溶解后,過濾、洗滌、烘干 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 純凈物 | 混合物 | 電解質 | 非電解質 |
| A | 純堿 | 冰水混合物 | 液態KNO3 | 蔗糖 |
| B | CaO | 海水 | 銅 | 乙醇 |
| C | 明礬 | 鋁合金 | AgCl | CO2 |
| D | 氫氧化鈉 | 空氣 | 氨水 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BaCl2 | B. | NaOH | C. | FeCl2 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol氯化氫和22.4升氮氣 | |
| B. | 2molCO2和3molH2 | |
| C. | 在標準狀況下16gO2和16gCH4 | |
| D. | 同溫同壓下,0.5mol氨氣和14克CO氣體 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省德州市高二上10月月考化學試卷(解析版) 題型:選擇題
如下圖兩個電解槽中,a、b、c、d均為石墨電極。若電解過程中共有0.02mol電子通過,下列敘述中正確的是( )

A.甲燒杯中a極上最多可析出銅0.64g
B.甲燒杯中b極上電極反應式4OH--4e-= 2H2O+O2↑
C.乙燒杯中滴入酚酞試液,d極附近先變紅
D.燒杯中c極上電極反應式為4H+ + 4e-=2H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ②⑤⑥ | C. | ③⑤ | D. | ②④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com