
【題目】硫酸錳是重要的微量元素肥料之一,易溶于水,難溶于乙醇。工業上用軟錳礦(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)通過如下簡化流程既可脫除燃煤尾氣中的SO2,又能制備硫酸錳晶體,實現了資源的綜合利用:
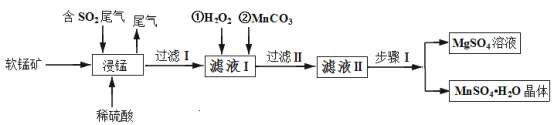
請回答下列問題:
(1)上述流程中第一步浸錳脫硫的好處是_________(答出一點即可)。
(2)寫出浸錳過程中軟錳礦中的MnO2發生的化學方程式_________。
(3)通過實驗如何判定濾液Ⅰ中已加入足量H2O2 __________;加MnCO3的目的是調節溶液的pH,使濾液Ⅰ中的相關離子形成沉淀而除去,請寫出 “過濾 Ⅱ”中所得濾渣的主要成分有________。
(4)已知硫酸錳晶體和硫酸鎂晶體的溶解度曲線如圖所示。
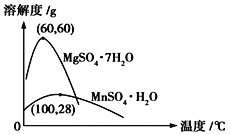
請寫出步驟Ⅰ操作_________、趁熱過濾;為了保證產品的純度,同時又減少產品的損失,應選擇下列溶液中的________(填選項字母)進行洗滌,實驗效果最佳。
A 乙醇 B 飽和K2SO4溶液 C 蒸餾水 D 乙醇水溶液
(5)濾液Ⅱ還可通過加入過量NH4HCO3進行“50℃碳化”得到高純碳酸錳,反應的離子方程式為_________。“50℃碳化”可能的原因是:_________。
【答案】實現了廢棄物的綜合利用或減少了酸雨的發生 MnO2+SO2 =MnSO4 取已加入一定量的H2O2的濾液Ⅰ少許置于試管中,加入少量的MnO2若有氣體逸出即說明H2O2 足量。(若用K3[Fe(CN)6]檢驗Fe2+ 亦可給分) Fe(OH)3;Al(OH)3 在60℃下蒸發結晶 D 2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑ 若溫度過高NH4HCO3易分解,不利于碳酸錳的生成,溫度低反應速率慢
【解析】
軟錳礦(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)加入稀硫酸后, Fe2O3、Al2O3、MgO分別轉變為Fe2(SO4)3 ,Al 2(SO4)3,Mg SO4,二氧化硅做為濾渣除去,MnO2與二氧化硫反應生成硫酸錳,加入過氧化氫是為了檢驗二氧化錳是否反應完,再加碳酸錳,除去Fe2(SO4)3 ,Al 2(SO4)3,Mg SO4和MnSO4晶體用蒸發結晶法分離。
(1)根據題意,通過如下簡化流程既可脫除燃煤尾氣中的SO2,又能制備硫酸錳晶體,實現了資源的綜合利用,上述流程中第一步浸錳脫硫是為了實現了廢棄物的綜合利用,減少了酸雨的發生;
(2)浸錳過程中軟錳礦中的MnO2與SO2反應,生成硫酸錳,化學方程式為MnO2+SO2 = MnSO4;
(3)檢驗H2O2是否過量,在二氧化錳做催化劑的條件下是否分解釋放氧氣,或者加入含Fe2+的K3[Fe(CN)6的溶液,H2O2過量會氧化Fe2+,藍色沉淀會褪色,則判斷方法為取已加入一定量的H2O2的濾液Ⅰ少許置于試管中,加入少量的MnO2若有氣體逸出即說明H2O2足量(或取已加入一定量的H2O2的濾液Ⅰ少許置于試管中,加入含Fe2+的K3[Fe(CN)6] 溶液,若藍色沉淀褪色,則說明H2O2 足量);加MnCO3調節溶液的pH,將Fe3+,Al3+生成難溶于水的氫氧化物,所得濾渣的主要成分有Fe(OH)3 ,Al(OH)3;
(4)從圖像可以看出,在60℃下,硫酸錳晶體的溶解度變化不大,硫酸鎂晶體的溶解度變化較大,溫度越高,溶解度越大,所以在60℃下蒸發結晶,可以得到較多的硫酸錳晶體,趁熱過濾;根據溶解度曲線可知,硫酸錳晶體與雜質硫酸鎂相比,雜質跟易溶于水需用水洗滌,但為減少產品的損失,應控制水的比例,則洗滌硫酸錳時最好選擇乙醇的水溶液最好;
(5)硫酸錳加入NH4HCO3制得碳酸錳,錳離子和碳酸根離子發生雙水解反應2HCO3-+Mn2+ = MnCO3↓+H2O+CO2↑;50℃碳化,說明反應不超過50℃最佳,由于碳酸氫銨易分解,生成氨氣,二氧化碳和水,一旦碳酸氫銨分解,不利于碳酸錳的生成,但是溫度也不能太低,溫度太低,反應速率太慢。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】在溫度T1和T2時,分別將0.50 mol CH4和1.20 mol NO2充入體積為1 L的密閉容器中,發生如下反應:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
時間/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列說法正確的是
A. T2時,CH4的平衡轉化率為30.0%
B. 該反應的△H>0、T1<T2
C. 保持其他條件不變,T1時向平衡體系中再充入0.30molCH4和0.80mol H2O(g),平衡向正反應方向移動
D. 保持其他條件不變,T1時向平衡體系中再充入0.50molCH4和1.20molNO2,與原平衡相比,達新平衡時N2的濃度增大、體積分數減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,pH=2的兩種一元酸x和y,體積均為100mL,稀釋過程中pH與溶液體積的關系如圖所示。分別滴加NaOH溶液至滴定終點,消耗NaOH溶液的體積為Vx、Vy,則

A.x為弱酸,Vx<VyB.x為強酸,Vx>Vy
C.y為弱酸,Vx<VyD.y為強酸,Vx>Vy
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L密閉容器中,800℃時反應2NO(g)+O2(g)![]() 2NO2(g)體系中,n(NO)隨時間的變化如表:
2NO2(g)體系中,n(NO)隨時間的變化如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反應________(填“是”或“不是”)可逆反應。
(2)如圖所示,表示NO2變化曲線的是______。用O2表示從0~2s內該反應的平均速率v=________。
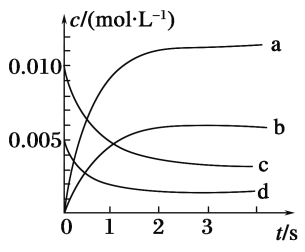
(3)能說明該反應已達到平衡狀態的是________(填序號)。
a.v(NO2)=2v(O2)
b.容器內壓強保持不變
c.v逆(NO)=2v正(O2)
d.容器內密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年8月3日我國確診首例非洲豬瘟疫情。目前某有效藥物的主要成分——姜黃素(分子式為C12H20O6)的一種合成路線如圖所示:
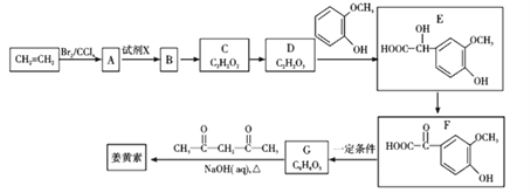
已知:
①![]()
![]() CH3CHO+CO2↑
CH3CHO+CO2↑
②CH3CHO+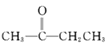
![]()
![]() +H2O
+H2O
回答下列問題:
(1)A的名稱為_________;試劑X為_________。
(2)D中含有的官能團名稱為_________。
(3)反應D→E的化學方程式為______________________________,其反應類型是________。
(4)下列有關G(C8H8O3)的敘述不正確的是_________(填正確答案編號)。
a.能與NaHCO3溶液反應 b.能與濃溴水發生取代反應
c.能與FeCl3溶液發生顯色反應 d.l mol G最多能與3 mol H2發生加成反應
(5)姜黃素的結構簡式為_________。
(6)G(C8H8O3)的同分異構體中,寫出同時符合下列條件的結構簡式為_________。
①苯環上的一取代物只有2種;
②核磁共振氫譜中有4組吸收峰;
③l mol該物質與燒堿溶液反應,最多消耗3 mol NaOH。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Anammox法是一種新型的氨氮去除技術。設阿伏加德羅常數的數值為NA,則下列說法正確的是

A.1moLNH4+所含電子數為11NA
B.30g N2H2中含有的共用電子對數目為4 NA
C.過程II屬于還原反應,過程IV屬于氧化反應
D.過程I中反應得到的還原產物與氧化產物物質的量之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D是四種短周期元素,它們的原子序數依次增大,其中,A、C及B、D分別是同主族元素;A元素的原子半徑是所有主族元素中原子半徑最小的;B、D兩元素的原子核中質子數之和是A、C兩元素原子核中質子數之和的2倍;四種元素所形成的單質中A、B單質是氣體,C、D單質是固體。
(1)寫出以下元素的名稱:B___;C___。
(2)寫出D元素在周期表中的位置___。
(3)用電子式表示C2D的形成過程:___。
(4)寫出由B、C兩元素所形成的原子個數比為1:1的化合物的的電子式___;屬于___(填“離子”或“共價”)化合物,存在的化學鍵的種類有___;寫出它與水反應的化學方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z四種短周期元素在元素周期表中的位置如圖所示,其中 W 元素的原子序數為Z元素原子序數的兩倍,下列說法正確的是
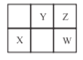
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三種元素對應原子的半徑依次減小
C.XZ2 和YZ2 的化學性質相似
D.利用 W 的含氧酸酸性強于Y 的含氧酸酸性,可證明非金屬性:W>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為有效控制霧霾,各地積極采取措施改善大氣質量。其中,控制空氣中氮氧化物和硫氧化物的含量尤為重要。
(1)煤燃燒產生的煙氣中含有氮的氧化物,用CH4催化還原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
則CH4催化還原NO的熱化學方程式為_______。
(2)將0.20mol NO和0.10mol CO充入一個溫度恒定、容積恒為2L的密閉容器中發生反應2NO(g)+2CO(g)=N2(g)+2CO2(g),可實現氮氧化物的轉化,反應過程中部分物質的物質的量變化如圖所示。
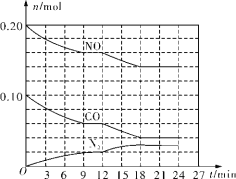
①N2在0~9min內的平均反應速率v(N2)=________mol/(L·min)(保留兩位有效數字)。
②第12min時改變的反應條件可能為________(填字母代號)。
a.充入水蒸氣稀釋反應物 b.加入NO c.加催化劑 d.增大壓強
(3)室溫下,煙氣中的SO2可用某濃度的NaOH溶液吸收得到pH=7的溶液,試計算所得溶液中![]() =_____(已知:常溫下H2SO3的電離平衡常數Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常溫下H2SO3的電離平衡常數Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)煙氣中的SO2也可用Na2SO3溶液吸收,吸收過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
當吸收液呈中性時,溶液中離子濃度關系正確的是(選填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com