
| A. | 食品保鮮膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入適量的生石灰能有效減少二氧化硫的排放量 | |
| C. | 若使用氯氣處理水,能達到消毒殺菌和除去懸浮雜質的目的 | |
| D. | 一定濃度的雙氧水可用于傷口的消毒 |
科目:高中化學 來源: 題型:解答題
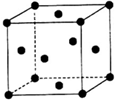 W、X、Y、Z(W、X、Y、Z分別代表元素符號)均為元素周期表中前四周期的元素,其原子序數依次增大,其中W、X、Y為短周期元素,它們的單質在通常狀況下均為無色氣體.X元素的基態原子在同周期元素基態原子中含有的未成對電子數最多,Y元素的基態原子中s能級上的電子數等于p能級上的電子數,Z為金屬元素,其基態原子是具有4s1結構的基態原子中質子數最多的原子,試回答下列各題:
W、X、Y、Z(W、X、Y、Z分別代表元素符號)均為元素周期表中前四周期的元素,其原子序數依次增大,其中W、X、Y為短周期元素,它們的單質在通常狀況下均為無色氣體.X元素的基態原子在同周期元素基態原子中含有的未成對電子數最多,Y元素的基態原子中s能級上的電子數等于p能級上的電子數,Z為金屬元素,其基態原子是具有4s1結構的基態原子中質子數最多的原子,試回答下列各題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為了保證食物的安全與色香味,我們應該研發高效低毒的農藥,科學使用食品添加劑,并用聚乙烯塑料袋進行包裝 | |
| B. | 汽車尾氣催化轉化裝置可將尾氣中的NO和 CO等有害氣體轉化為N2和CO2,該裝置中的催化劑可降低NO和CO反應的活化能,但不能提高該反應的平衡轉化率 | |
| C. | 石油裂解的主要目的是提高汽油等輕質油的產量與質量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 | |
| D. | 推廣乙醇汽油,CO2的捕捉與封存都符合低碳經濟與低碳生活 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 弱酸 | 電離平衡常數(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
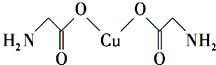 (1)鈉鎂鋁三種元素中第一電離能最大的是Mg.
(1)鈉鎂鋁三種元素中第一電離能最大的是Mg.| 元 素 | Mn | Fe | |
| 電離能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 分子式 | 結構簡式 | 熔點 | 沸點 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
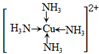 (標出配位鍵);
(標出配位鍵);查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L NaHCO3溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液與10 mL 0.1 mol/L鹽酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室溫下,pH=2的鹽酸與pH=12的氨水等體積混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | A | B | C | D | E |
| 性質或結構信息 | 室溫下單質呈氣態,原子最外層電子數與D相同 | D3B中陽離子與陰離子的電子層結構相同 | A和C可形成兩種常見的化合物甲和乙,乙具有弱酸性 | 單質質軟、銀白色固體、導電性強,在空氣中燃燒生成淡黃色固體 | E是一種氣態氧化物丙,丙相對于空氣的密度為3.0,溶于水可得只含單一溶質的弱酸性溶液,該溶液在放置過程中其酸性會增強 |
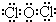 ;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com