
 (對苯醌)═N2H4+
(對苯醌)═N2H4+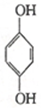 (對苯酚),N2H4的結構式為
(對苯酚),N2H4的結構式為 ,該電池正極的電極反應式為
,該電池正極的電極反應式為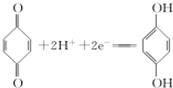 .
.| 溫度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
分析 (1)肼相當于氨氣分子中一個氫原子被氨基取代;
該電池正極上 得到電子生成
得到電子生成 ;
;
(2)①根據電荷守恒及c(Cl-)=c(NH4+)判斷溶液中氫離子濃度和氫氧根離子濃度相對大小,從而確定溶液的酸堿性,得出正確結論;
②根據電荷守恒及c(Cl-)<c(NH4+)判斷溶液中氫離子濃度和氫氧根離子濃度相對大小,從而確定溶液的酸堿性,得出正確結論;
(3)①根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積,書寫平衡常數表達式,分析平衡常數隨溫度變化,結合平衡移動原理分析反應熱量變化情況;
②依據濃度商和平衡常數的比較,判斷反應進行的方向;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
利用蓋斯定律進行計算,由①+2×②得出正確結論.
解答 解:(1)肼中相當于氨氣分子中一個氫原子被氨基取代,所以肼的結構式為 ;
;
該電池正極上 得到電子生成
得到電子生成 ,電極反應式為:
,電極反應式為: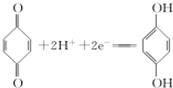 ,
,
故答案為: ;
;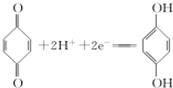 ;
;
(2)①根據電荷守恒得:c(Cl-)+c(OH-)=c(NH4+)+c(H+),溶液中c(Cl-)=c(NH4+),所以c(OH-)=c(H+),所以溶液呈中性,即pH=7,
故答案為:7;
②根據電荷守恒得:c(NH4+)+c(H+)=c(OH-)+c(Cl-),當c(NH4+)>c(Cl-)時,則c(H+)<c(OH-),溶液呈堿性;
a.鹽酸不足,氨水剩余,溶液顯堿性,與題意相符,故a可選;
b.氨水與鹽酸恰好反應,生成氯化銨,銨根離子水解顯酸性,與題意不符,故b不選;
c.鹽酸過量,溶液呈酸性,與題意不符,故c不選;
故答案為:a;
(3)①N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,平衡常數K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
由表中數據可知:平衡常數隨溫度升高而減小,說明升高溫度,平衡逆向進行,逆向是吸熱反應,故正反應為放熱反應,故b小于0,
故答案為:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;小于;
②400°C N2(g)+3H2(g)?2NH3(g)的K=0.5,400℃時,測得氨氣、氮氣、氫氣的物質的量分別為3mol、2mol、1mol時,濃度分別為$\frac{3}{0.5}$=6mol/L,$\frac{2}{0.5}$=4mol/L,$\frac{1}{0.5}$=2mol/L,Qc=$\frac{{6}^{2}}{4×{2}^{3}}$=1.1>K,說明平衡逆向進行,v正(N2)<v逆(N2);
故答案為:小于;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
由①+2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=(-1266.8kJ•mol-1)+(+180.5kJ•mol-1)=-905.8KJ/mol,
故答案為:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
點評 本題考查的知識點較多,涉及結構式、電極反應式的書寫,溶液中離子濃度大小的判斷,平衡常數的計算和化學平衡移動原理,以及蓋斯定律的應用,綜合性較強,濃度較大.要注意掌握根據濃度商和平衡常數的比較,判斷反應進行的方向.


科目:高中化學 來源: 題型:選擇題
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮與水的反應是氧化還原反應 | |
| C. | 二氧化氮不是造成大氣污染的氣體之一 | |
| D. | 在通常狀況下測得的NO2的相對分子質量是不準確的 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
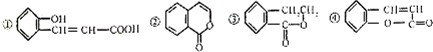
| A. | 只有①能和碳酸鈉反應放出氣體 | B. | ②和④互為同分異構體 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④與H2加成后可以得到③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1mol丙烯中含碳原子數為3NA | |
| B. | 常溫下,pH=13的NaOH溶液中含OH-數目為NA | |
| C. | 23gNa與足量氧氣反應時轉移的電子數為2NA | |
| D. | 標準狀況下,22.4LCHCl3中含C-H鍵數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 白色沉淀甲是Al(OH)3,氣體甲是CO2,原混合物中一定含有Al3+和HCO3- | |
| B. | 白色沉淀乙是BaSO4,原混合物中一定含有SO42- | |
| C. | 氣體乙一定是NO和NO2的混合氣體 | |
| D. | 原混合物中一定含有Na+、Al3+、NO3-、SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 離子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高錳酸鉀溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀產生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液無色透明且遇甲基橙顯紅色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
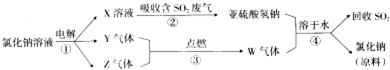
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com