
分析 (1)反應Ⅰ的熱化學方程式可以依據反應Ⅱ、Ⅲ熱化學方程式計算得到,同時得到反應的焓變;
(2)反應Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1是氣體探究增大的吸熱反應,熵變△S>0,焓變△H>0,反應自發進行的判斷依據是△H-T△S<0;
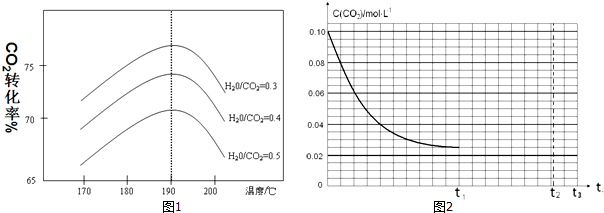
(3)①不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和溫度影響CO2平衡轉化率變化的趨勢曲線分析可知,
②反應Ⅲ是放熱反應,升溫平衡逆向進行;
(4)依據熱化學方程式2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ•mol-1 ,結合平衡常數的概念書寫;平衡常數只受溫度影響,結合絕熱容器中溫度變化,判斷平衡移動方向,再判斷平衡常數的變化;
(5)圖象分析二氧化碳的平衡濃度為0.025mol/L,體積縮小一半濃度增大一倍應為0.05mol/L,隨反應進行達到平衡狀態,因為生成物為固體,最后達到相同平衡狀態,二氧化碳濃度不變,據此畫出變化曲線;
(6)分析尿素結構可知,和羰基連接的氨基據此性質分析推斷.
解答 解:(1)反應Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1=akJ•mol-1
反應Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1
總反應Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1
依據蓋斯定律計算反應Ⅰ+反應Ⅱ得到:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=akJ•mol-1+72.49kJ•mol-1=-86.98kJ•mol-1
a=-159.47akJ•mol-1,
故答案為:-159.47;
(2)反應Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1是氣體探究增大的吸熱反應,熵變△S>0,焓變△H>0,反應自發進行的判斷依據是△H-T△S<0,則滿足此關系應是高溫條件下,反應自發進行,
故答案為:>,高溫;
(3)①反應Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,其他條件相同時,為提高CO2的平衡轉化率,平衡正向進行,依據圖象中的水碳比數據分析判斷,生產中可以采取的措施是降低水碳比,二氧化碳轉化率增大,故答案為:降低;
②反應Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,是放熱反應,升溫高于190°C,依據圖象分析可知,二氧化碳轉化率減小,因為溫度升高,平衡逆向進行,
故答案為:溫度高于190℃時,因為反應Ⅲ是放熱反應,溫度升高平衡向逆方向進行,CO2的平衡轉化率降低;
(4)反應Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=-159.47kJ•mol-1,平衡常數K=$\frac{1}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$;反應若在絕熱容器中進行,隨著反應的進行,容器內溫度升高,平衡狀態會逆向移動,平常常數減小;故答案為:$\frac{1}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$;減小;
(5)在恒溫下將0.4mol NH3和0.2mol CO2放入容積為2L的密閉容器中,達到平衡時,
2NH3(g)+CO2(g)?NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
變化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1時達到平衡過程中c(CO2)隨時間t變化趨勢曲線如圖2所示.若其他條件不變,t1時將容器體積壓縮到1L,二氧化碳濃度應增大到0.05mol/L,壓強增大,平衡正向進行,由于生成物是固體,所以達到平衡狀態,二氧化碳濃度保持不變,據此畫出變化曲線為: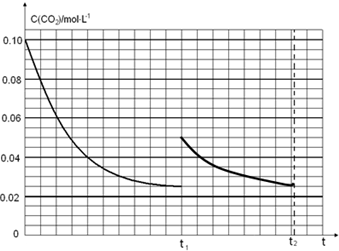 ,故答案為:
,故答案為: ;
;
(6)尿素在土壤中會發生反應CO(NH2)2+2H2O?(NH4)2CO3.分析結構特征可知,物質性質取決于官能團,尿素中氨基和羰基相連和水反應生成銨根離子,所以選項中符合此結果特征的有類似性質:
A.NH2COONH4 ,結構中含有與羰基連接的氨基,故A符合;
B.H2NOCCH2CH2CONH2 結構中含有與羰基連接的氨基,故B符合;
C.HOCH2CH2OH,結構中不含有氨基,故C不符合;
D.HOCH2CH2NH2,分子中的氨基不是和羰基連接,不具備次性質,故D不符合;
故答案為:A、B.
點評 本題考查了熱化學方程式書寫,反應自發進行的判斷依據,化學平衡的標志判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 0.5 mol白磷(P4,結構如圖)含有2NA個P-P鍵 | |
| B. | 23g鈉與在一定條件下與氧氣作用,若兩者均無剩余,轉移NA個電子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA個,NH+4少于2NA個 | |
| D. | 常溫常壓下22.4L的CO2在一定條件下與足量的鎂反應,轉移4NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 熱化學方程式 | 平衡常數 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 共價鍵 | C-O | H-O | N-H | C-N |
| 鍵能/kJ•mol-1 | 351 | 463 | 393 | 293 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 (1)用CO2和氫氣合成CH3OCH3(甲醚)是解決能源危機的研究方向之一.
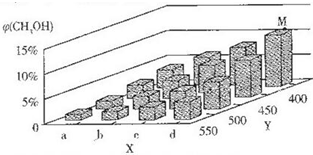
(1)用CO2和氫氣合成CH3OCH3(甲醚)是解決能源危機的研究方向之一.| 實驗 編號 | 溫度/℃ | 起始時物質的量/mol | 平衡時物質的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚氯乙烯的結構簡式為: | B. | 乙醇的官能團的電子式為: | ||
| C. | S2-的結構示意圖為: | D. | 乙酸的實驗式為C2H4O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反應 | ||
| C. | 蘇打、小蘇打水溶液的pH都大于7 | D. | I2,NH4Cl晶體受熱都逐漸消失 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com