
| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=-114.6 kJ•mol-1此時中和熱△H=-114.6 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol-1 | |
| C. | H2SO4和NaOH反應的中和熱△H=-57.3 kJ•mol-1 | |
| D. | 稀醋酸與稀NaOH溶液反應生成1 mol水,放出57.3 kJ 熱量 |
分析 A.在稀溶液中,稀的酸跟堿發生中和反應而生成1mo水,這時的反應熱叫做中和熱;
B.酸堿中和反應為放熱反應;
C.在稀溶液中,稀的酸跟堿發生中和反應而生成1mo水,這時的反應熱叫做中和熱;
D.弱酸電離時吸熱.
解答 解:A.在稀溶液中,稀的酸跟堿發生中和反應而生成1mo水,這時的反應熱叫做中和熱,中和熱為△H=-57.3 kJ•mol-1,則KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1,故A錯誤;
B.酸堿中和反應為放熱反應,則NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,故B錯誤;
C.H2SO4和NaOH反應硫酸鈉和水,所以中和熱△H=-57.3 kJ•mol-1,故C正確;
D.弱酸電離時吸熱,則稀醋酸與稀NaOH溶液反應生成1 mol水,放出的熱量小于57.3 kJ,故D錯誤.
故選C.
點評 本題主要考查學生對中和熱的概念的理解和掌握以及熱化學方程式的書寫問題,題目難度不大,注意弱酸的電離過程要吸熱.


科目:高中化學 來源: 題型:解答題
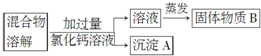
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬腐蝕就是金屬失去電子被還原的過程 | |
| B. | 銅板上的鐵鉚釘處在潮濕的空氣中直接發生反應:Fe-3e+=Fe3+,繼而形成鐵銹 | |
| C. | 將水庫中的水閘(鋼板)與外加直流電源的負極相連接,正極連接到一個廢鐵上可防止水閘被腐蝕 | |
| D. | 合金的熔點都高于它的成分金屬,合金的耐腐蝕性也都比其成分金屬強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡是放熱反應都是自發的,吸熱反應都是非自發的 | |
| B. | 化學反應的方向與反應的熵變無關 | |
| C. | 室溫下,CaCO3(s)=CaO(s)+CO2(g)不能自發進行,說明該反應△H<0 | |
| D. | 同一物質:固體→液體→氣體的變化是焓增和熵增的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 萃取操作時,可以選用CCl4或酒精作為萃取劑從溴水中萃取溴 | |
| B. | 蒸發操作時,應使混合物中的水分完全蒸干后,才能停止加熱 | |
| C. | 分液操作時,先將分液漏斗中下層液體從下口放出,再將上層液體從下口放出 | |
| D. | 蒸餾操作時,應向蒸餾液體中加入幾塊沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體系壓強保持不變 | |
| B. | 混合氣體顏色保持不變 | |
| C. | SO3的體積百分數保持不變 | |
| D. | 每消耗1 mol SO3的同時生成1 mol NO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖是Zn和Cu形成的原電池,下列描述合理的是( )
如圖是Zn和Cu形成的原電池,下列描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3在反應中得到電子 | B. | O2在反應中失去電子 | ||
| C. | NO是反應的還原產物 | D. | 1mol氧化劑在反應中得到4mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com