
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中正確的是

A.1molNH4+所含的質子總數為10NA(設NA為阿伏加德羅常數的值)
B.該方法每處理1molNH4+,需要0.5molNO2-
C.過程IV中,NO2-發生氧化反應
D.N2H2中含有σ鍵和π鍵
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向一個2 L的真空密閉容器中(預先裝入催化劑)通入1 mol N2和3 mol H2,經過一段時間后,測得容器內壓強是起始時的0.9倍。在此時間段內H2的平均反應速率為0.1 mol·L-1·min-1,則經過時間為( )
A. 2 minB. 3 minC. 4 minD. 5 min
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅(CuCl)是白色粉末,微溶于水,酸性條件下不穩定,易生成金屬 Cu 和Cu2+,廣泛應用于化工和印染等行業。某研究性學習小組擬熱分解 CuC122H2O 制備 CuCl,并進行相關探究。下列說法不正確的是( )
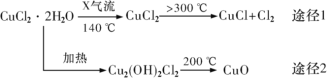
A.途徑 1 中產生的Cl2 可以回收循環利用
B.途徑 2 中 200℃時反應的化學方程式為:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 氣體是HCl,目的是抑制 CuCl22H2O 加熱過程可能的水解
D.CuCl 與稀硫酸反應的離子方程式為:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一體積不變的密閉容器中加入2 mol A、0.6 mol C和一定量的B三種氣體。一定條件下發生反應2A(g) + B(g)![]() 3C(g),各物質濃度隨時間變化如圖1所示。圖2為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件。已知t3~t4階段為使用催化劑;圖1中t0~t1階段c(B)未畫出。
3C(g),各物質濃度隨時間變化如圖1所示。圖2為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件。已知t3~t4階段為使用催化劑;圖1中t0~t1階段c(B)未畫出。
圖1 圖2
圖2
(1)若t1=15 min,則t0~t1階段以C濃度變化表示的反應速率為v(C)=________。
(2)t4~t5階段改變的條件為________,B的起始物質的量為________。各階段平衡時對應的平衡常數如下表所示:
t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
K1 | K2 | K3 | K4 | K5 |
則K1=____________(計算式),K1、K2、K3、K4、K5之間的關系為____________(用“>”“<”或“=”連接)。
(3)t5~t6階段保持容器內溫度不變,若A的物質的量共變化了0.01 mol,而此過程中容器與外界的熱交換總量為a kJ,該反應的熱化學方程式:2A(g) + B(g)![]() 3C(g) ΔH,用含有a的代數式表達 ΔH = _________。
3C(g) ΔH,用含有a的代數式表達 ΔH = _________。
(4)在相同條件下,若起始時容器中加入4mol A、2 mol B和1.2 mol C,達到平衡時,體系中 C的百分含量比t1時刻C的百分含量________(填“大于”“小于”“等于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將W1g光亮的銅絲在空氣中加熱一段時間后,迅速伸入下列物質中,取出干燥,如此反復幾次,最后取出銅絲用蒸餾水洗滌、干燥,稱得其質量為W2g。實驗時由于所伸入的物質不同,銅絲的前后質量變化可能不同,下列所插物質與銅絲的質量關系正確的是
A.NaOH溶液,W1=W2B.無水乙醇,W1=W2
C.NaHSO4溶液,W1<W2D.CO,W1>W2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】還原沉淀法是處理含鉻(含Cr2O72-和CrO42-)工業廢水的常用方法,過程如下:

已知:轉化過程中的反應為2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常溫下Ksp[Cr(OH)3]=1×10-32。下列說法錯誤的是( )
Cr2O72-(aq)+H2O(l)。常溫下Ksp[Cr(OH)3]=1×10-32。下列說法錯誤的是( )
A.反應①v正(CrO42-)=2v逆(Cr2O72-)時,反應處于平衡狀態
B.反應②轉移0.6mole-,則有0.2mol Cr2O72-被還原
C.除去廢水中含鉻離子的過程包括氧化還原反應和復分解反應
D.常溫下,要使處理后廢水中的c(Cr3+)降至1×10-5mol·L-1,反應③應調溶液pH=5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究化學能與熱能的轉化,某實驗小組設計了如下圖所示的三套實驗裝置:

(1)上述3個裝置中,不能驗證“銅與濃硝酸的反應是吸熱反應還是放熱反應”的裝置是________(填裝置序號)。
(2)某同學選用裝置Ⅰ進行實驗(實驗前U形管里液面左右相平),在甲試管中加入適量了Ba(OH)2溶液與稀硫酸,U形管中可觀察到的現象是_________________________________。說明該反應屬于________(填“吸熱”或“放熱”)反應。
(3)為探究固體M溶于水的熱效應,選擇裝置Ⅱ進行實驗(反應在丙試管中進行)。
①若M為鈉,則實驗過程中燒杯中可觀察到的現象是_________________。
②若觀察到燒杯中產生氣泡,則說明M溶于水________(填“一定是放熱反應”、“一定是吸熱反應”或“可能是放熱反應”),理由是_________________________________________。
(4)至少有兩種實驗方法能驗證超氧化鉀與水的反應(4KO2+2H2O===4KOH+3O2↑)是放熱反應還是吸熱反應。
方法①:選擇裝置________(填裝置序號)進行實驗;
方法②:取適量超氧化鉀粉末用脫脂棉包裹并放在石棉網上,向脫脂棉上滴加幾滴蒸餾水,片刻后,若觀察到脫脂棉燃燒,則說明該反應是________(填“吸熱”或“放熱”)反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,3—環己二酮(![]() )常用作醫藥中間體,用于有機合成。下列是一種合成1,3—環己二酮的路線。
)常用作醫藥中間體,用于有機合成。下列是一種合成1,3—環己二酮的路線。

回答下列問題:
(1)甲的分子式為__________。
(2)丙中含有官能團的名稱是__________。
(3)反應①的反應類型是________;反應②的反應類型是_______。
(4)反應④的化學方程式_______。
(5)符合下列條件的乙的同分異構體共有______種。
①能發生銀鏡反應
②能與NaHCO3溶液反應,且1mol乙與足量NaHCO3溶液反應時產生氣體22.4L(標準狀況)。
寫出其中在核磁共振氫譜中峰面積之比為1∶6∶2∶1的一種同分異構體的結構簡式:________。(任意一種)
(6)設計以![]() (丙酮)、乙醇為原料制備
(丙酮)、乙醇為原料制備![]() (2,4—戊二醇)的合成路線(無機試劑任選)_______。
(2,4—戊二醇)的合成路線(無機試劑任選)_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容條件下,能說明反應A(s)+ 2B(g)![]() C(g)+ D(g)一定處于化學平衡狀態的是
C(g)+ D(g)一定處于化學平衡狀態的是
A. 混合氣體的密度不再改變 B. 容器內的壓強保持不變
C. C與D的物質的量相等 D. 消耗1 mol B的同時生成 0.5 mol D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com