

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 開始沉淀時的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀時的pH | 9.0 | 3.2 | 4.7 |
| 實驗操作 | 現象 | 結論 |
| 取適量產品于潔凈燒杯中,加入適量蒸餾水,充分攪拌,靜置,濾去沉淀. | 得黃棕色溶液 | |
| 取少量溶液于試管中,滴加溶液 ①0.05mol/L酸性高錳酸鉀; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于試管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③產生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
分析 (1)依據氫氧化鐵膠體具有吸附懸浮雜質的作用分析凈水原理;
(2)沉淀完全時溶解時溶液中金屬離子的濃度為1.0×10-5mol/L,氫氧化亞鐵完全沉淀的PH=9,結合離子積常數和溶度積常數計算得到;加入少量NaHCO3調溶液pH=6的目的是把溶液中的鋁離子全部沉淀;
(3)流程分析反應Ⅱ是亞硝酸鈉在酸溶液中氧化亞鐵離子為鐵離子,依據氧化還原反應電子守恒和電荷守恒,原子守恒配平寫出;依據氧化還原反應電子守恒計算;
(4)證明不含有亞鐵離子需要選擇高錳酸鉀溶液褪色與否進行實驗驗證,證明含有硫酸根離子的實驗是依據硫酸根離子檢驗方法選擇試劑檢驗,根據提供的試劑需要選擇氯化鋇溶液和稀硝酸.
解答 解:(1)堿式硫酸鐵能夠凈水的原因是,堿式硫酸鐵在溶液中鐵離子水解生成了具有較強吸附能量的氫氧化鐵膠體,吸附懸浮在水中雜質的起到凈水作用;
故答案為:能水解生成具有吸附能力較強的膠體;
(2)沉淀完全時溶解時溶液中金屬離子的濃度為1.0×10-5mol/L,氫氧化亞鐵完全沉淀的PH=9,c(H+)=10-9mol/L,c(OH-)=10-5mol/L,依據溶度積常數計算方法得到Ksp=c(Fe2+)c2(OH-)=1.0×10-5mol/L×(10-5mol/L)2=1×10-15(mol/L)3;加入少量NaHCO3調溶液pH=6的目的是把溶液中的鋁離子全部沉淀;
故答案為:1×10-15(mol/L)3;調節溶液PH促進Al3+水解轉化為沉淀除去;
(3)分析反應Ⅱ是亞硝酸鈉在酸溶液中氧化亞鐵離子為鐵離子,依據氧化還原反應電子守恒和電荷守恒,原子守恒寫出的離子方程式為:Fe2++2H++NO2-=Fe3++NO↑+H2O;在實際生產中,常同時通入O2以減少反應II中NaNO2的用量.若實際生產中需要節約1.38t的NaNO2用量,物質的量=$\frac{1.38t}{69g/mol}$=2×104mol,轉移電子2×104mol,依據電子守恒計算:
4NaNO2~4NO~4e-~O2~4e-
4 1
2×104mol n(O2)
n(O2)=5×103mol
V(O2)=5×103mol×22.4mol/L=1.12×105L=112m3;
則應通入標準 狀況下的02 的體積為112m3;
故答案為:Fe2++2H++NO2-=Fe3++NO↑+H2O;112;
(4)根據提供的試劑設計實驗檢驗所得產品中不含 Fe2+,含有SO42-,實驗證明不含有亞鐵離子需要選擇高錳酸鉀溶液褪色與否進行實驗驗證,證明含有硫酸根離子的實驗是依據硫酸根離子檢驗方法選擇試劑檢驗,具體步驟為:取適量產品于潔凈燒杯中,加入適量蒸餾水,充分攪拌,靜置,濾去沉淀,得黃棕色溶液,取少量溶液于試管中,滴加0.05mol/l的酸性高錳酸鉀溶液,溶液不褪色證明溶液中不含Fe2+,取少量溶液于試管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案為:
| 操 作 | 現 象 |
| 0.05 mol/L酸性高錳酸鉀溶液 | 溶液不褪色 |
| 產生白色沉淀 |
點評 本題考查了實驗制備物質的分析應用,離子檢驗方法和設計,化學方程式,氧化還原反應電子守恒的計算式解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
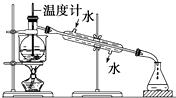 (1)從含碘的有機溶液中提取碘和回收有機溶劑,需要經過蒸餾,指出下面蒸餾裝置圖中的錯誤之處.
(1)從含碘的有機溶液中提取碘和回收有機溶劑,需要經過蒸餾,指出下面蒸餾裝置圖中的錯誤之處.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .某探究小組在實驗室探究阿司匹林的合成,主要原料是水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O],制備基本實驗流程如下:
.某探究小組在實驗室探究阿司匹林的合成,主要原料是水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O],制備基本實驗流程如下:
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水溶性 |
| 水楊酸 | 132 | 158(熔點) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸點) | 與水反應 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
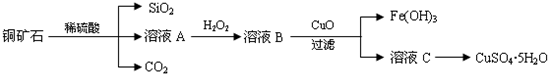
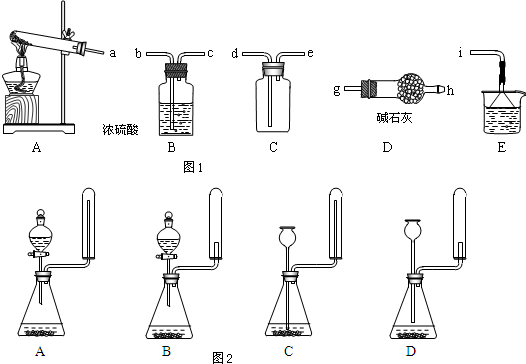
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCN | B. | CH3COOH | C. | HF | D. | HNO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 弱電解質需要通電才能發生電離 | |
| B. | 醋酸達到電離平衡時,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共價化合物,所以它是弱電解質 | |
| D. | 電離平衡右移,電解質分子的濃度不一定減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com