
| A. | 1 mol OT-含有的質子數、中子數均為10NA | |
| B. | 25℃,101kPa時,4.90LNH3含有的分子數約為0.2NA | |
| C. | 常溫常壓下,6g二氧化硅中所含硅氧鍵數目為0.2NA | |
| D. | 50mL12mol•L-1鹽酸與足量MnO2共熱,轉移的電子數為0.3NA |
分析 A.1個OT-含有9個質子,含有10個中子;
B.25℃,101kPa時,Vm≈22.4L/mol;
C.依據n=$\frac{m}{M}$計算物質的量,結合二氧化硅所含化學鍵為4個Si-O鍵計算;
D.二氧化錳只能與濃鹽酸反應,稀鹽酸和二氧化錳不反應.
解答 解:A.1 mol OT-含有的質子數9NA、中子數均為10NA,故A錯誤;
B.25℃,101kPa時,Vm略大于22.4L/mol,4.90LNH3含有的分子物質的量約為0.2mol,所含分子數約為0.2NA,故B正確;
C.6g二氧化硅物質的量=$\frac{6g}{60g/mol}$=0.1mol,二氧化硅所含化學鍵為4個Si-O鍵,6g二氧化硅含有Si-O鍵數目為0.4NA,故C錯誤;
D.二氧化錳只能與濃鹽酸反應,一旦濃鹽酸變稀,反應即停止,4molHCl反應時轉移2mol電子,而50mL12mol/L鹽酸的物質的量n=CV=12mol/L×0.05L=0.6mol,這0.6mol鹽酸不能完全反應,則轉移的電子的物質的量小于0.3mol電子,即小于0.3NA個,故D錯誤;
故選:B.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,注意氣體摩爾體積使用條件和對象,注意二氧化硅的結構,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他條件不變,向平衡體系中再充入0.32molA,再達到新平衡時,B的轉化率增大 | |
| B. | 其他條件不變,降低溫度,反應達到新平衡前ν(逆)>ν(正) | |
| C. | 其他條件不變,起始時向容器中充入0.64molA和B,平衡時,n(C)<0.48mol | |
| D. | 反應前2min的平均速率ν(C)=0.004mol•(L•min)-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 檢驗方法 | 結論 |
| A | 向一種未知溶液中加入鹽酸,產生能使澄清石灰水變渾濁的無色無味的氣體 | 未知溶液中一定含有CO${\;}_{3}^{2-}$ |
| B | 向一種未知溶液中滴加NaOH溶液,產生白色沉淀 | 未知溶液中一定含有Al3+ |
| C | 向一種未知溶液中先加入鹽酸酸化,再加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 用潔凈的鉑絲蘸取一種未知液在酒精燈外焰上灼燒火焰呈黃色 | 不能確定未知溶液中一定沒有含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=3的強酸溶液1mL,加水稀釋至100mL后,溶液pH降低2個單位 | |
| B. | pH=2的鹽酸中水電離出的H+濃度小于pH=12的氨水中水電離出的OH-濃度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定濃度的NaHSO3溶液pH=5.4,則c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
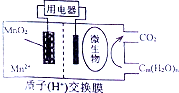
| A. | MnO2極為負極 | |
| B. | Cn(H2O)m發生了氧化反應 | |
| C. | 電子從負極區經交換膜移向正極區 | |
| D. | 放電過程中,H+從正極區移向負極區 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 欲配制500mL 0.5mol•L-1的NaOH溶液,試回答下列問題.
欲配制500mL 0.5mol•L-1的NaOH溶液,試回答下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com