
| A. | 室溫時,在水電離出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常溫下,將pH=4的醋酸溶液稀釋后,溶液中所有離子的濃度均降低 | |
| C. | 常溫下,pH=2的醋酸溶液中所含有的H+數為0.01 NA | |
| D. | 將92 g N2O4晶體放入容器中,恢復到常溫常壓時,所含氣體分子數大于NA |
分析 A.在水電離出c(H+)=1.0×10-12mol•L-1的溶液,為酸或堿溶液;
B.常溫下,將pH=4的醋酸溶液稀釋后,氫離子濃度減小,Kw不變;
C.溶液體積未知,不能由n=cV計算;
D.存在N2O4?2NO2,92 g N2O4晶體的物質的量為1mol,則反應體系中氣體的物質的量大于1mol.
解答 解:A.在水電離出c(H+)=1.0×10-12mol•L-1的溶液,為酸或堿溶液,HCO3-與酸、堿均反應,一定不能共存,故A錯誤;
B.常溫下,將pH=4的醋酸溶液稀釋后,氫離子濃度減小,Kw不變,則氫氧根離子濃度增大,故B錯誤;
C.溶液體積未知,不能由n=cV計算,則不能計算H+數,故C錯誤;
D.存在N2O4?2NO2,92 g N2O4晶體的物質的量為1mol,則反應體系中氣體的物質的量大于1mol,所含氣體分子數大于NA,故D正確;
故選D.
點評 本題考查較綜合,涉及離子的共存、pH的計算、弱電解質的電離平衡及化學平衡等,為高頻考點,把握常見離子之間的反應、反應原理為解答的關鍵,側重分析與應用能力的考查,綜合性較強,題目難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A>C>D>B | B. | A>B>C>D | C. | C>A>D>B | D. | C>B>D>A |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
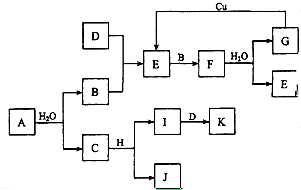 A~K為中學化學的常見物質,它們之間有如下圖所示的轉化關系(反應條件已略去).已知:通常狀況下,A是淡黃色固體,B、D和I都是無色氣體單質,F是紅棕色氣體,H是金屬單質.回答下列問題:
A~K為中學化學的常見物質,它們之間有如下圖所示的轉化關系(反應條件已略去).已知:通常狀況下,A是淡黃色固體,B、D和I都是無色氣體單質,F是紅棕色氣體,H是金屬單質.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)CO是高爐煉鐵的主要反應物之一,發生的主要反應為:
(1)CO是高爐煉鐵的主要反應物之一,發生的主要反應為:| 溫度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
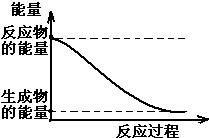 (1)20世紀30年代,Eyring和Pzer在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是NO2和CO反應生成CO2和NO過程中的能量變化示意圖,說明這個反應是放熱.(填“吸熱”或“放熱”)反應,NO2和CO的總能量大于(填
(1)20世紀30年代,Eyring和Pzer在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是NO2和CO反應生成CO2和NO過程中的能量變化示意圖,說明這個反應是放熱.(填“吸熱”或“放熱”)反應,NO2和CO的總能量大于(填查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | [Ne]3s1[Ne]3s2 | B. | [Ar]4s1[Ne]3s23p4 | ||
| C. | [Ne]3s2[Ar]4s2 | D. | [He]2s22p4[Ne]3s23p5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com