
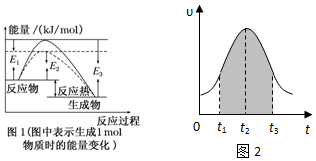
分析 (1)由圖1可知反應物的總能量大于生成物的總能量,則該反應為放熱反應,生成1mol氨氣時放出的熱量為(E3-E1)kg,然后利用化學計量數與反應熱的關系并標明物質的狀態來書寫熱化學反應方程式;
(2)由圖象可知,反應速率先增大后減小,隨著反應的進行,反應物濃度逐漸減小,反應中錳離子為反應的催化劑,陰影面積為濃度的變化,以此解答該題.
解答 解:(1)由圖可知該反應為放熱反應,且生成1mol生成物放出的熱量為(E3-E1)kg,則生成2mol生成物放熱為2(E3-E1)kg,即該反應的熱化學方程式為N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol,
故答案為:N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1) kJ/mol;
(2)①隨著反應的進行,濃度逐漸減小,但速率增大,說明反應中產生的Mn2+離子是此反應的催化劑,催化劑使反應速率增大的影響大于反應物濃度減小使反應速率減小的影響,
故答案為:反應中產生的Mn2+離子是此反應的催化劑,催化劑使反應速率增大的影響大于反應物濃度減小使反應速率減小的影響;
②隨著反應的進行,反應物的濃度降低,濃度越低,反應速率越小,所以濃度的改變是反應速率變化的主要原因,
故答案為:隨著反應的進行,反應物濃度逐漸減小,成為影響反應速率的主要因素,從而反應速率減小;
③根據v=$\frac{△c}{△t}$,推倒得v×△t=△C,所以陰影面積表示反應物濃度的減少或生成物濃度的增加,故選AD.
點評 本題綜合考查化學反應速率以及熱化學方程式,為高頻考點,側重于學生的分析、計算能力的考查,注意把握圖象的分析,難度不大.


 作業輔導系列答案
作業輔導系列答案 同步學典一課多練系列答案
同步學典一課多練系列答案 經典密卷系列答案
經典密卷系列答案科目:高中化學 來源: 題型:填空題
 以乙烯為原料,可以制備乙酸乙酯
以乙烯為原料,可以制備乙酸乙酯查看答案和解析>>
科目:高中化學 來源: 題型:解答題

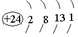 與鉻同周期的所有元素的基態原子中最外層電子數與鉻原子相同的元素有K、Cu(填元素符號),其中一種金屬的晶胞結構如圖1所示,該晶胞中含有金屬原子的數目為4.
與鉻同周期的所有元素的基態原子中最外層電子數與鉻原子相同的元素有K、Cu(填元素符號),其中一種金屬的晶胞結構如圖1所示,該晶胞中含有金屬原子的數目為4.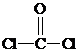 ,其中碳氧原子之間共價鍵是c(填序號)
,其中碳氧原子之間共價鍵是c(填序號)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
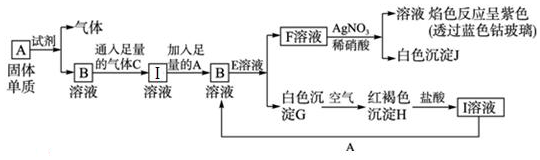
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉和纖維素都可以在酸性條件下水解生成葡萄糖 | |
| B. | 煤的氣化、液化和干餾都是煤綜合利用的主要方法,都屬于物理變化 | |
| C. | 地溝油發生皂化反應后加入飽和食鹽水,攪拌發現液面上有固體物質 | |
| D. | 蛋白質溶液中加入濃的硫酸銨溶液,有固體析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯與溴水發生加成反應而使溴水褪色 | |
| B. | 苯與溴水發生取代反應而使溴水褪色 | |
| C. | 苯不能使酸性高錳酸鉀溶液褪色 | |
| D. | 苯與濃硝酸、濃硫酸的混合物發生的反應不是取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純凈物:水銀、氫氧化鐵固體、冰水混合物 | |
| B. | 堿性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 鹽:純堿、小蘇打、燒堿 | |
| D. | 電解質:CH3COOH、H2O、NH3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com