
| ||
| △ |
| 0.09mol |
| 5L×0.5min |
| m |
| V |


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:
| A、同周期元素中,ⅦA族元素的原子半徑最大 |
| B、ⅠA族元素的原子,其半徑越大,越容易得到電子 |
| C、室溫時,零族元素的單質都是氣體 |
| D、所有主族元素的原子,形成單原子離子時的化合價與它的族序數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、0.4 mol |
| B、0.6 mol |
| C、0.8 mol |
| D、1.2 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 組別 | 10%硫酸體積/mL | 溫度/℃ | 其他物質 |
| A | 2mL | 20 | |
| B | 2mL | 20 | 10滴飽和MnSO4溶液 |
| C | 2mL | 30 | |
| D | 1mL | 20 | V1 mL蒸餾水 |
| E | 0.5mL | 20 | V2 mL蒸餾水 |
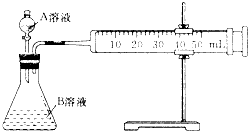
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
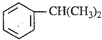 ),是一種重要的有機化工原料.根據題意完成下列填空:
),是一種重要的有機化工原料.根據題意完成下列填空: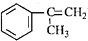 )是生產耐熱型ABS樹脂的一種單體,工業上由異丙苯催化脫氫得到.寫出由異丙苯制取該單體的另一種方法
)是生產耐熱型ABS樹脂的一種單體,工業上由異丙苯催化脫氫得到.寫出由異丙苯制取該單體的另一種方法查看答案和解析>>
科目:高中化學 來源: 題型:
| 名稱 | 托盤天平 | 小燒杯 | 坩堝鉗 | 玻璃棒 | 藥匙 | 量筒 |
| 儀器 |  |  |  |  |  | |
| 序號 | a | b | c | d | e | f |
| 實驗 次數 | 起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 放電 |
| 充電 |
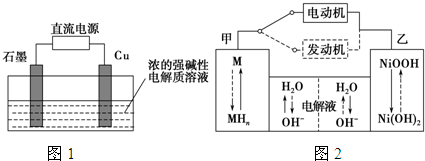
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com