
【題目】對廢銀合金觸電材料進行分離回收既節約礦物資源,又可以減少環境污染。某廢銀合金觸電材料含Ag、Cu、Sn等,現欲利用以下工藝流程回收其中的金屬資源。
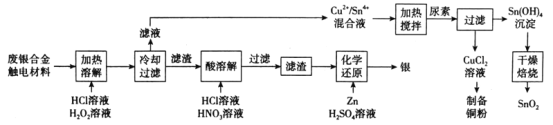
回答下列問題:
(1)“加熱溶解”時Cu發生的離子方程式為_________。
(2)“加熱溶解”時溫度常控制在50℃左右,溫度不宜過高也不宜過低的原因為_________。
(3)“酸溶解”過程中會產生少量遇空氣變為紅棕色的無色氣體,則“酸溶解”過程主要的化學方程式為_____________。
(4)常溫下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,將混合液“加熱攪拌”后冷卻至室溫,再加“尿素”調節溶液的pH范圍為__________。(當溶液中的離子濃度小于10-5mol·L-1時,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)檢驗Sn(OH)4沉淀是否洗滌干凈的方法是____________。
(6)用惰性電極電解CuCl2溶液,陰極反應式是___________,若想由CuCl2溶液得到無水CuCl2固體,則需進行的實驗操作為_______________。
【答案】Cu+2H++H2O2![]() Cu2++2H2O 低于50℃,溶解反應較慢,超過50℃,H2O2分解與HCl逸出導致溶解翻譯速率下降 3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O 1.5≤pH<5 取最后一次洗滌液少量于試管中,滴入稀硝酸,再加入硝酸銀溶液,若沒有白色沉淀生成,證明洗滌干凈,反之,沉淀沒有洗滌干凈 Cu2++2e-===Cu 將CuCl2溶液在HCl氣流中加熱蒸干
Cu2++2H2O 低于50℃,溶解反應較慢,超過50℃,H2O2分解與HCl逸出導致溶解翻譯速率下降 3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O 1.5≤pH<5 取最后一次洗滌液少量于試管中,滴入稀硝酸,再加入硝酸銀溶液,若沒有白色沉淀生成,證明洗滌干凈,反之,沉淀沒有洗滌干凈 Cu2++2e-===Cu 將CuCl2溶液在HCl氣流中加熱蒸干
【解析】
結合題干信息,根據工藝流程圖分析可知,某廢銀合金觸電材料含Ag、Cu、Sn等,在加熱、溶解的條件下通入H2O2和HCl溶液,Cu和Sn變成Cu2+和Sn4+,再通入尿素在加熱的條件下得到CuCl2溶液和Sn(OH)4沉淀,最終經過系列操作得到銅粉和SnO2,Ag單質以濾渣的形式經過HNO3和HCl溶液的溶解得到AgCl的沉淀,再加入Zn和H2SO4溶液進行化學反應得到Ag單質,據此分析解答問題。
(1)根據上述分析,“加熱溶解”時,Cu與HCl、H2O2反應變為Cu2+,離子反應方程式為Cu+2H++H2O2![]() Cu2++2H2O,故答案為:Cu+2H++H2O2
Cu2++2H2O,故答案為:Cu+2H++H2O2![]() Cu2++2H2O;
Cu2++2H2O;
(2)溫度過低,反應速率慢,溫度過高,反應物H2O2分解,則溫度不宜過高也不宜過低的原因是低于50℃,溶解反應較慢,超過50℃,H2O2分解與HCl逸出導致溶解翻譯速率下降,故答案為:低于50℃,溶解反應較慢,超過50℃,H2O2分解與HCl逸出導致溶解翻譯速率下降;
(3)根據上述分析可知,“濾渣”主要成分為Ag,“酸溶解”過程為Ag和HNO3、HCl反應得到AgCl的沉淀,化學反應方程式為:3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O,故答案為:3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O;
(4)調節pH為保證Sn4+沉淀完全(離子濃度小于10-5mol·L-1),按c(Sn4+)=1×10-5 mol·L-1進行計算,根據Ksp[Sn(OH)4]=1×10-55可得,c(OH-)=1×10-12.5 mol·L-1,則c(H+)=1×10-1.5 mol·L-1,pH=1.5,為保證Cu2+(0.022 mol·L-1)不沉淀,按c(Cu2+)=0.022 mol·L-1進行計算,根據Ksp[Cu(OH)2]=2.2×10-20可得,c(OH-)=1×10-9 mol·L-1,則c(H+)=1×10-5 mol·L-1,pH=5,則pH的取值范圍1.5≤pH<5,故答案為:1.5≤pH<5;
(5)沉淀中可能附著的有Cl-,檢驗是否洗凈的方法可以是取最后一次洗滌液少量于試管中,滴入稀硝酸,再加入硝酸銀溶液,若沒有白色沉淀生成,證明洗滌干凈,反之,沉淀沒有洗滌干凈,故答案為:取最后一次洗滌液少量于試管中,滴入稀硝酸,再加入硝酸銀溶液,若沒有白色沉淀生成,證明洗滌干凈,反之,沉淀沒有洗滌干凈;
(6)惰性電極電解CuCl2溶液時,陰極Cu2+得到電子,電極反應為Cu2++2e-===Cu,由于CuCl2會水解,可在蒸發時通入HCl氣體抑制水解,故答案為:Cu2++2e-===Cu;將CuCl2溶液在HCl氣流中加熱蒸干。


科目:高中化學 來源: 題型:
【題目】氮化鎵(GaN)是一種重要的半導體材料。某工廠利用鋁土礦(成分為Al2O3、Ga2O3、Fe2O3等)為原料制備GaN的流程如下圖所示:
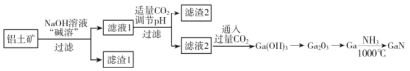
已知:鎵與鋁同主族,鎵的熔點是29.8°C,沸點是2403°C;其氧化物和氫氧化物均為兩性化合物;氫氧化物的電離常數如下:
兩性氫氧化物 | Al( OH)3 | Ga( OH)3 |
酸式電離常數Ka | 2×10-11 | 1×10-7 |
堿式電離常數Kb | 1.3×10-33 | 1.4×10-34 |
回答下列問題:
(1)為了提高 “堿溶”效率應采用的措施是__________(回答兩種措施)。
(2)濾渣1的成分是_________。
(3)濾液2中通入過量CO2的理由是________(用離子方程式表示)。
(4)流程中利用鎵與NH3在1000℃反應生成固體半導體材料 GaN,每生成l molGaN時放出15. 45 kJ熱量,寫出該反應的熱化學方程式________。
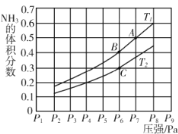
(5)在密閉容器中,充入一定量的Ga與NH3發生反應 ,測得反應平衡體系中NH3的體積分數與壓強 P和溫度T 的關系曲線如下圖所示。圖中A 點和C點化學平衡常數的大小關系: KA____KC (填“<”“=”或 “ > ”) , 判斷的依據是________。
(6)已知鋁土礦中Ga2O3的質量分數為 a%,某工廠使用 w 噸鋁土礦經過一系列反應, 反應過程中鎵元素的總利用率為 b%能制得________噸氮化鎵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據vt圖分析外界條件改變對可逆反應A(g)+3B(g) ![]() 2C(g) ΔH<0的影響。該反應的速率與時間的關系如圖所示:
2C(g) ΔH<0的影響。該反應的速率與時間的關系如圖所示:
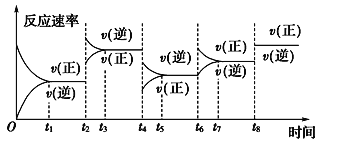
可見在t1、t3、t5、t7時反應都達到平衡,如果t2、t4、t6、t8時都只改變了一個反應條件,則下列對t2、t4、t6、t8時改變條件的判斷正確的是
A. 使用了催化劑、增大壓強、減小反應物濃度、降低溫度
B. 升高溫度、減小壓強、減小反應物濃度、使用了催化劑
C. 增大反應物濃度、使用了催化劑、減小壓強、升高溫度
D. 升高溫度、減小壓強、增大反應物濃度、使用了催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡圖象如圖所示(不考慮![]() 的水解,pAg=
的水解,pAg=![]() lgc(Ag+)),下列說法正確的是
lgc(Ag+)),下列說法正確的是
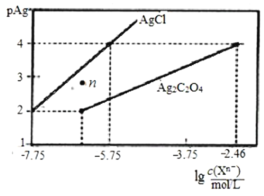
A.KspAg2C2O4的數量級等于10-10
B.n點表示AgCl的過飽和溶液
C.向c(Cl-)=c(![]() )的混合液中滴入AgNO3溶液時,先生成Ag2C2O4沉淀
)的混合液中滴入AgNO3溶液時,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-![]() 2AgCl+
2AgCl+![]() 的平衡常數為103.29
的平衡常數為103.29
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】麻黃素M是擬交感神經藥。合成M的一種路線如圖所示:
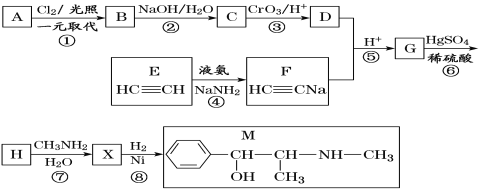
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
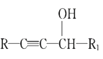
IV.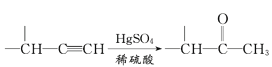
V.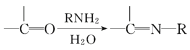
請回答下列問題:
(1)D的名稱是_______;G中含氧官能團的名稱是_______。
(2)反應②的反應類型為_______;A的結構簡式為_______。
(3)寫出反應⑦的化學方程式:______________________________。
(4)X分子中最多有_______個碳原子共平面。
(5)在H的同分異構體中,同時能發生水解反應和銀鏡反應的芳香族化合物中,核磁共振氫譜上有4組峰,且峰面積之比為1∶1∶2∶6的有機物的結構簡式為_________________。
(6)已知:![]() 仿照上述流程,設計以苯、乙醛為主要原料合成某藥物中間體
仿照上述流程,設計以苯、乙醛為主要原料合成某藥物中間體![]() 的路線________________。
的路線________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個2L的密閉容器中,投入反應物,發生反應2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,其中SO3的變化如下圖所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的變化如下圖所示:
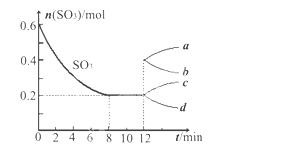
(1)寫出該反應的平衡常數表達式并根據8min時到達平衡計算出結果________________。
(2)用O2表示0到8min內該反應的平均速率v=__________________。
(3)升高溫度,該反應的K值將______;容器中氣體的平均相對分子質量將______。(填“增大”“減小”或“不變”)
(4)能說明該反應已達到平衡狀態的是________。
A.v(SO3)=2v(O2) B.容器內壓強保持不變
C.v(SO2)逆=2v(O2)正 D.容器內密度保持不變
(5)在第12min時,容器壓縮到1L,則SO3的變化曲線為_______。
A.a B.b C.c D.d
(6)若保持容積不變在第12min時,加入SO3(g),則平衡向_______反應方向移動(填“正” 或“逆”)。SO3的體積分數_______(填“增大”或“減小”)。
(7)將相同物質的量的SO3充入下面的兩個容器中,已知甲容器有活塞可以上下移動,乙容器體積固定,在相同的溫度、壓強下開始發生反應,在反應過程中維持體系溫度不變。
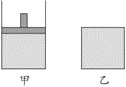
①反應達平衡所需時間甲________乙(填“大于”“等于”或“小于”);達平衡時SO3的轉化率甲__________乙(“大于”“等于”或“小于”)。
②若平衡后,向甲、乙中分別充入惰性氣體,__________(填“甲”或“乙”)容器的平衡將向__________(填“正”或“逆”)反應方向移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學按照課本實驗要求,用50mL0.50mol/L的鹽酸于50mL0.55mol/L的NaOH溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量計算中和熱,下列說法中,正確的是( )
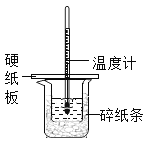
A. 燒杯間填滿碎紙條的作用是固定小燒杯
B. 用如圖裝置可以完成中和熱測定的實驗
C. 為防止混合溶液時濺出產生誤差,因此混合時速度要慢
D. 若將鹽酸體積改為60mL,不考慮熱量損失,理論上所求中和熱相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類比pH的定義,對于稀溶液可以定義pC(X)=-lgc(X),pKa=-lgKa,常溫下,某濃度H2A溶液在不同pH下,測得pC(H2A)、pC(HA-)、pC(A2-)變化如圖所示,下列說法正確的是
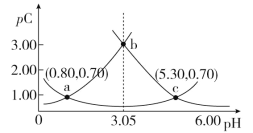
A.隨著pH的增大,pC增大的曲線是A2-的物質的量濃度的負對數
B.pH=4.50時,c(HA-)>c(A2-)=c(H2A)
C.b點時, =104.50
=104.50
D.pH=3.00~5.30時,c(H2A)+c(HA-)+c(A2-)先減小后增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組用酸性KMnO4溶液和草酸(H2C2O4)溶液反應,研究外界條件反應速率的影響,設計了如下探究實驗方案:
實驗 | 草酸溶液 (0.5mol/L) | 高錳酸鉀 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸錳 (0.5mol/L) | 溫度 | 蒸餾水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列問題:
(1)本方案中用于設計實驗的化學反應的離子方程式是____,實驗中預計通過觀察什么現象或測定什么數據來進行判斷:_____。
(2)該實驗的目的是____。
(3)實驗③中的Vx=____;實驗①和④測得反應速率分別為v1、v4,則v1____v4(填:“>”“<”和“=”)
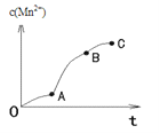
(4)實驗①中,c(Mn2+)與t關系如圖所示。AB段斜率明顯大于OA段斜率,除反應可能放熱外,猜想還可能是_____,利用提供的試劑設計實驗III,驗證猜想。
提供的試劑:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固體,蒸餾水
①補全實驗III的操作:向試管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,應觀察到的實驗現象是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com