
化學與人類生產、生活密切相關,下列說法正確的是
A. 減少SO2的排放,可以從根本上消除霧霾
B. 硅酸多孔、吸水能力強,常用作袋裝食品的干燥
C. 綠色化學的核心是利用化學原理對環境污染進行治理
D. 醫用消毒酒精中乙醇的濃度為95%
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2017屆江蘇省高三下學期期初考試化學試卷(解析版) 題型:選擇題
液體燃料電池相比于氣體燃料電池具有體積小,無需氣體存儲裝置等優點。一種以肼(N2H4)為燃料的電池裝置如圖所示。該電池用空氣中的氧氣作為氧化劑, KOH作為電解質。下列關于該燃料電池的敘述不正確的是( )
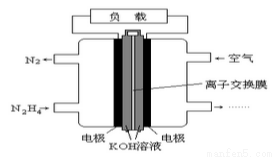
A. 電流從右側電極經過負載后流向左側電極
B. 負極發生的電極反應式為:N2H4+4OH-+4e - =N2+4H2O
C. 該燃料電池的電極材料應采用多孔導電材料,以提高電極反應物質在電極表面的吸附量,并使它們與電解質溶液充分接觸
D. 該電池持續放電時,K+從負極向正極遷移,因而離子交換膜需選用陽離子交換膜
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市高一下學期分班考試化學試卷(解析版) 題型:選擇題
現有25 mL 2 mol·L-1Na2CO3溶液和75 mL 1 mol·L-1的稀鹽酸。①將Na2CO3溶液緩慢滴到稀鹽酸中;②將稀鹽酸緩慢滴加到Na2CO3溶液中,在標準狀況下產生的氣體的體積( )
A. 均為0.84 L B. 均為0.56 L
C. ①>② D. ②>①
查看答案和解析>>
科目:高中化學 來源:2017屆江西省協作體高三下學期第一次聯考理綜化學試卷(解析版) 題型:選擇題
下列說法中不正確的是( )
A. 鼓勵使用太陽能、風能等清潔能源能減少PM2.5的污染
B. 與銅質水龍頭連接處的鋼質水管易發生腐蝕
C. 發酵粉中含有較多的NaHCO3,能使焙制出的糕點疏松多孔
D. 東漢魏伯陽在《周易參同契》中對汞的描述“……得火則飛,不見埃塵,將欲制之,黃芽為根。”這里黃芽指的是黃銅
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三下學期開學考試理綜化學試卷(解析版) 題型:選擇題
常溫下,實驗測得1.0mol/LNH4HCO3溶液pH=8.0。平衡時碳的分布系數(各含碳微粒的濃度占含碳各種微粒濃度之和的分數)與pH的關系如圖所示。下列說法正確的是
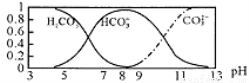
A. 常溫下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13時,溶液中不存在HCO3-的水解平衡
C. pH由8~11時,c(CO32-)·c(H+)/c(HCO3-)不變
D. pH=3時,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省牡丹江市高二上學期開學檢測化學試卷(解析版) 題型:實驗題
醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
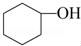

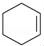 +H2O
+H2O
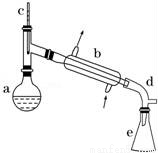
可能用到的有關數據如下:
相對分子質量 | 密度/(g•cm﹣3) | 沸點/℃ | 溶解性 | |
環己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
環己烯 | 82 | 0.810 2 | 83 | 難溶于水 |
合成反應:
在a中加入20g環己醇和2小片碎瓷片,冷卻攪動下慢慢加入1mL濃硫酸.b中通入冷卻水后,開始緩慢加熱a,控制餾出物的溫度不超過90℃.
分離提純:
反應粗產物倒入分液漏斗中分別用少量5%碳酸鈉溶液和水洗滌,分離后加入無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣.最終通過蒸餾得到純凈環己烯10g.
回答下列問題:
(1)裝置b的名稱是__________.
(2)加入碎瓷片的作用是_________;如果加熱一段時間后發現忘記加瓷片,應該采取的正確操作是________(填正確答案標號).
A.立即補加 B.冷卻后補加 C.不需補加 D.重新配料
(3)本實驗中最容易產生的副產物的結構簡式為________________________.
(4)分液漏斗在使用前須清洗干凈并__________;在本實驗分離過程中,產物應該從分液漏斗的______________(填“上口倒出”或“下口放出”).
(5)分離提純過程中加入無水氯化鈣的目的是_______________.
(6)在環己烯粗產物蒸餾過程中,不可能用到的儀器有______(填正確答案標號).
A.蒸餾燒瓶 B.溫度計 C.吸濾瓶 D.冷凝管 E.接收器
(7)本實驗所得到的環己烯產率是________(填正確答案標號).
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省牡丹江市高二上學期開學檢測化學試卷(解析版) 題型:選擇題
已知下面三個數據:①7.2×10-4、②2.6×10-4、③4.9×10-10分別是三種酸的電離平衡常數,若已知這三種酸可發生如下反應:
NaCN+HNO2==HCN+NaNO2
NaCN+HF==HCN+NaF
NaNO2+HF==HNO2+NaF
由此可判斷下列敘述中正確的是
A. HF的電離常數是① B. HNO2的電離常數是①
C. HCN的電離常數是② D. HNO2的電離常數是③
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三2月月考理科綜合化學試卷(解析版) 題型:推斷題
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現如圖所示的物質之間的變化:
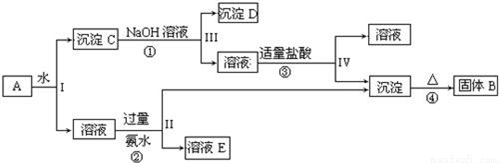
據此回答下列問題:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中對于溶液和沉淀的分離采取的方法是_____.
(2)根據上述框圖反應關系,寫出下列B、C、D、E所含物質的化學式
沉淀固體B______;C________;沉淀D_____;溶液E________.
(3)寫出①、②、③、④四個反應方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省馬鞍山市高二上學期期末考試化學試卷(解析版) 題型:選擇題
下圖為實驗室制取少量乙酸乙酯的裝置圖。下列關于該實驗的敘述中,不正確的是( )
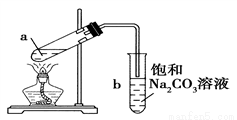
A. 向a試管中先加入濃硫酸,然后邊搖動試管邊慢慢加入乙醇,再加冰醋酸
B. 試管b中導氣管下端管口不能浸入液面的原因是防止實驗過程中發生倒吸現象
C. 實驗時加熱試管a的目的是加快反應速率并及時將乙酸乙酯蒸出
D. 試管b中飽和Na2CO3溶液的作用是吸收隨乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com