
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 顏色 | 黃色 | 綠色 | 藍色 |
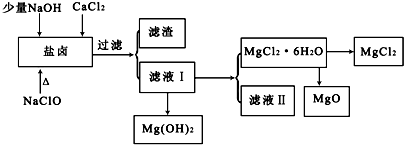
分析 向鹽鹵溶液中加入NaClO,NaClO具有強氧化性,能將Fe2+氧化為Fe3+,向鹽鹵中加入少量NaOH,NaOH和Fe3+反應生成Fe(OH)3,CO(NH2)2和NaClO發生氧化還原反應,生成物除鹽外,都是能參與大氣循環的物質,所以生成物是NaCl、CO2、N2、H2O,過量二氧化碳能和NaOH反應生成碳酸氫鈉,將溶液過濾得到的濾渣是Fe(OH)3,濾液I中含有Mg2+、Cl-、Na+,將濾液I蒸發、結晶、過濾得到MgCl2•6H2O,則濾液中含有的雜質離子是Na+,直接將MgCl2•6H2O加強熱能得到MgO,發生反應MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl↑+5H2O↑,氯化鎂易水解,所以不能用加熱MgCl2•6H2O方法制取氯化鎂,要在HCl氛圍中制取氯化鎂;
(1)溶液中得到溶質晶體的方法是加熱濃縮、冷卻結晶、過濾洗滌;
(2)鎂離子在水溶液中易水解生成氫氧化鎂沉淀;
(3)用NaClO除去尿素CO(NH2)2時,生成物除鹽外,都是能參與大氣循環的物質,判斷反應生成氯化鈉、氮氣、二氧化碳和水,次氯酸鈉具有強氧化性,能將亞鐵離子氧化為鐵離子;
(4)①A、從鹽鹵或海水中獲得Mg(OH)2,工業上選擇生石灰作沉淀劑;
B、Mg(OH)2分解吸熱,且MgO不能燃燒;
C、MgO熔點太高,工業上電解氯化鎂制取鎂;
②Mg(OH)2的飽和溶液中的溶度積計算飽和溶液中的氫氧根離子濃度,結合水溶液中離子積計算氫離子濃度計算pH,然后結合表中數據判斷溶液所呈現的顏色.
解答 解:向鹽鹵溶液中加入NaClO,NaClO具有強氧化性,能將Fe2+氧化為Fe3+,向鹽鹵中加入少量NaOH,NaOH和Fe3+反應生成Fe(OH)3,CO(NH2)2和NaClO發生氧化還原反應,生成物除鹽外,都是能參與大氣循環的物質,所以生成物是NaCl、CO2、N2、H2O,過量二氧化碳能和NaOH反應生成碳酸氫鈉,將溶液過濾得到的濾渣是Fe(OH)3,濾液I中含有Mg2+、Cl-、Na+,將濾液I蒸發、結晶、過濾得到MgCl2•6H2O,則濾液中含有的雜質離子是Na+,直接將MgCl2•6H2O加強熱能得到MgO,發生反應MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl↑+5H2O↑,氯化鎂易水解,所以不能用加熱MgCl2•6H2O方法制取氯化鎂,要在HCl氛圍中制取氯化鎂;
(1)從MgCl2溶液得到MgCl2.6H2O晶體的過程,加熱濃縮、冷卻結晶、過濾洗滌,所以選擇BCE,
故答案為:BCE;
(2)直接將MgCl2•6H2O加強熱能得到MgO,同時還生成HCl和水蒸氣,反應方程式為MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl↑+5H2O↑,氯化鎂易水解,為防止氯化鎂水解,在制取氯化鎂時,要將MgCl2•6H2O放在氯化氫氣體中,防止Mg2+水解,Mg2++2H2O?Mg(OH)2+2H+,
故答案為:防止Mg2+水解,Mg2++2H2O?Mg(OH)2+2H+;
(3)通過以上分析知,該反應為3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O,次氯酸鈉具有強氧化性,能將亞鐵離子氧化為鐵離子,再轉化為氫氧化鐵沉淀而除去,
故答案為:3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O;氧化Fe2+使它變成Fe(OH)3沉淀而除去;
(4)①A、從鹽鹵或海水中獲得Mg(OH)2,工業上選擇生石灰作沉淀劑,故A錯誤;
B、Mg(OH)2分解吸熱,且MgO不能燃燒,所以Mg(OH)2能作阻燃劑是它分解吸熱且生成MgO覆蓋可燃物,故B正確;
C、MgO熔點太高,工業上電解氯化鎂制取鎂,故C錯誤;
故答案為:B;
②25℃時,Mg(OH)2的溶度積Ksp=5.6×10-12,根據反應Mg(OH)2(s)?Mg2++2OH-可得:c(Mg2+)•c2(OH-)=5.6×10-12,
設c(OH-)=2c(Mg2+)=x,則:0.5x×x2=5.6×10-12,
解得:x=2.24×10-4mol/L,
c(H+)=$\frac{10{\;}^{-14}}{2.24×10{\;}^{-4}}$mol/L=4.5×10-11mol/L,
溶液的pH=10.4>9.6,所以溶液呈藍色,
故答案為:藍色.
點評 本題考查了鹽類水解、反應化學反應自發進行的條件、化學實驗操作方法的綜合應用等知識,難度中等,試題涉及的知識點較多,全面考查了學生的分析、理解能力,正確分析題中數據為解答關鍵,難度較大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
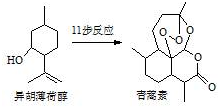 2015年我國藥物化學家屠吆吆因發明抗瘧疾新藥青蒿素和雙氫青蒿素被授予諾貝爾生理學或醫學獎.以異胡薄荷醇為起始原料是人工合成青蒿素的途徑之一(如圖).下列說法正確的是( )
2015年我國藥物化學家屠吆吆因發明抗瘧疾新藥青蒿素和雙氫青蒿素被授予諾貝爾生理學或醫學獎.以異胡薄荷醇為起始原料是人工合成青蒿素的途徑之一(如圖).下列說法正確的是( )| A. | 異胡薄荷醇遇FeCl3溶液顯紫色 | |
| B. | 異胡薄荷醇可發生消去反應、加成反應 | |
| C. | 青蒿素分子中含有5個手性碳原子 | |
| D. | 青蒿素在熱的酸、堿溶液中均可穩定存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
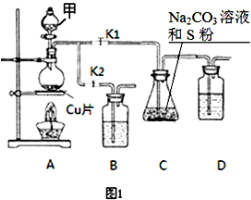 硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.
硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.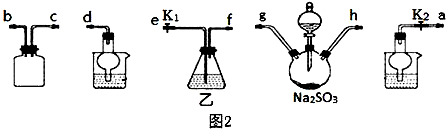
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊變紅的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能與金屬鋁反應放出氫氣的溶液:K+ NO3- SO42- NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 有機物 屬于芳香烴,含有兩種官能團 屬于芳香烴,含有兩種官能團 | |
| B. | 按系統命名法,化合物 的名稱為2,3,6三甲基5乙基庚烷 的名稱為2,3,6三甲基5乙基庚烷 | |
| C. |  既屬于醇類又屬于羧酸 既屬于醇類又屬于羧酸 | |
| D. | 2甲基3丁烯的命名錯誤原因是選錯了主鏈 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com