
分析 (1)根據氫離子的物質的量相等計算稀釋后溶液中氫離子濃度,再計算溶液的PH;
(2)酸溶液混合,先計算混合后溶液中氫離子的物質的量,再根據c=$\frac{n}{V}$計算氫離子的物質的量濃度,最后根據pH=-lgc(H+)計算出混合液的pH.
解答 解:(1)10mLpH=4的硫酸,稀釋10倍到100mL時,溶液體積增大10倍,則氫離子濃度減小為原來的$\frac{1}{10}$,所以其pH增大1,稀釋后溶液的pH=5,故答案為:5;
(2)pH=3的鹽酸和pH=5的硫酸等體積混合后,設體積均為VL,
混合液中氫離子的物質的量為:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,
則混合溶液中氫離子濃度為:c(H+)=$\frac{1{0}^{-3}mol}{2VL}$=5×10-4mol/L,
所以pH=-lg5×10-4=4-lg5=3.3,
故答案為:3.3.
點評 本題考查了混合液的pH的計算,題目難度不大,試題側重基礎知識的考查,注意掌握pH的表達式及計算方法,明確溶液酸堿性與溶液pH的關系為解答關鍵,試題有利于培養學生的化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 周期表從左到右,元素的電負性逐漸變大 | |
| B. | 周期表從上到下,元素的電負性逐漸變大 | |
| C. | 電負性越大,金屬性越強 | |
| D. | 電負性越小,非金屬性越強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
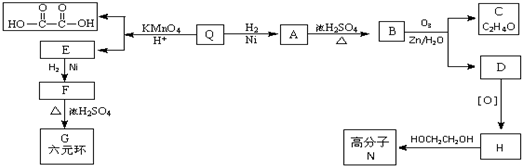
 ;Q的反式結構簡式是
;Q的反式結構簡式是 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 K2S
K2S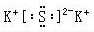 NaOH
NaOH
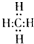 ,分子里各原子的空間分布呈正四面體結構.分子式為C4Hm的烷烴,m值等于10;并寫出它的同分異構體的結構簡式CH3CH2CH2CH3、(CH3)2CHCH3.
,分子里各原子的空間分布呈正四面體結構.分子式為C4Hm的烷烴,m值等于10;并寫出它的同分異構體的結構簡式CH3CH2CH2CH3、(CH3)2CHCH3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、環己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
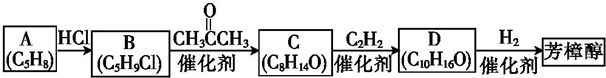
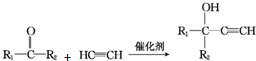 (R1、R2均為烴基)
(R1、R2均為烴基) ,該反應類型為加成反應.
,該反應類型為加成反應.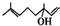 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com