
【題目】將![]() 和
和![]() 置于預(yù)先抽成真空的特制2L恒容密閉容器中,加熱至1500K,體系達(dá)到平衡,總壓強為
置于預(yù)先抽成真空的特制2L恒容密閉容器中,加熱至1500K,體系達(dá)到平衡,總壓強為![]() 體系中存在以下反應(yīng)關(guān)系:
體系中存在以下反應(yīng)關(guān)系:![]()
![]()
![]()
![]()
回答下列問題:
(1)![]() 與
與![]() 、
、![]() 、
、![]() 的關(guān)系是______。
的關(guān)系是______。
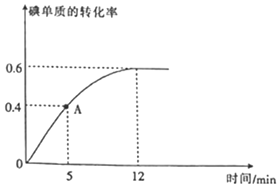
(2)![]() 反應(yīng)過程中碘單質(zhì)的轉(zhuǎn)化率隨時間的變化曲線如圖所示,A點時
反應(yīng)過程中碘單質(zhì)的轉(zhuǎn)化率隨時間的變化曲線如圖所示,A點時![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)達(dá)到平衡狀態(tài)時,氫氣的物質(zhì)的量分?jǐn)?shù)是______;![]() ______;
______;![]() ______
______![]() 保留2位有效數(shù)字
保留2位有效數(shù)字![]() 為用平衡分壓代替濃度表示的平衡常數(shù),平衡分壓
為用平衡分壓代替濃度表示的平衡常數(shù),平衡分壓![]() 總壓強
總壓強![]() 物質(zhì)的量分?jǐn)?shù)
物質(zhì)的量分?jǐn)?shù)![]() 。
。
(4)下列說法能說明該體系達(dá)到平衡狀態(tài)的是______。
A.顏色不再變化
B.氣體平均相對分子質(zhì)量不再變化
C.氣體密度不再變化
D.溫度不再變化
(5)![]() 是一種強酸,常溫下將
是一種強酸,常溫下將![]() 的HI溶液和
的HI溶液和![]() 的氨水等體積混合后,溶液呈中性。此時溶液中離子濃度的大小關(guān)系是______。
的氨水等體積混合后,溶液呈中性。此時溶液中離子濃度的大小關(guān)系是______。
【答案】![]()
![]()
![]()
![]() 9
9 ![]() AD
AD ![]()
【解析】
(1)![]() ,
,![]() ,
,![]()
![]() ,根據(jù)蓋斯定律
,根據(jù)蓋斯定律![]() 計算
計算![]() 的焓變
的焓變![]() ;
;
(2)由圖可知,A點時反應(yīng)正向進(jìn)行,碘單質(zhì)的轉(zhuǎn)化率為![]() ,則
,則![]() ,根據(jù)
,根據(jù)![]() 計算
計算![]() ,結(jié)合反應(yīng)的速率之比等于計量數(shù)之比求出
,結(jié)合反應(yīng)的速率之比等于計量數(shù)之比求出![]() ;
;
(3)根據(jù)反應(yīng)三段式計算達(dá)到平衡狀態(tài)時氫氣的物質(zhì)的量,將平衡分壓代入![]() 表達(dá)式
表達(dá)式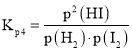 中計算
中計算![]() ;由于反應(yīng)
;由于反應(yīng)![]() ,即
,即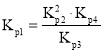 ,則
,則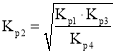 ;
;
(4)反應(yīng)達(dá)到平衡狀態(tài)時,正逆反應(yīng)速率相等,各物質(zhì)的濃度、百分含量不變,以及由此衍生的一些量也不發(fā)生變化,解題時要注意,選擇判斷的物理量,隨著反應(yīng)的進(jìn)行發(fā)生變化,當(dāng)該物理量由變化到定值時,說明可逆反應(yīng)到達(dá)平衡狀態(tài);
(5)![]() 是一種強酸,一水合氨是弱堿,常溫下將
是一種強酸,一水合氨是弱堿,常溫下將![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等體積混合后,溶液呈中性,此時溶質(zhì)為
的氨水等體積混合后,溶液呈中性,此時溶質(zhì)為![]() 和氨水,根據(jù)電荷守恒
和氨水,根據(jù)電荷守恒![]() ,因為溶液呈中性,則
,因為溶液呈中性,則![]() ,所以
,所以![]() ,據(jù)此進(jìn)行分析。
,據(jù)此進(jìn)行分析。
(1)![]()
![]()
![]()
![]()
根據(jù)蓋斯定律![]() 計算
計算![]() 的焓變
的焓變![]() ,即
,即![]() ,
,
故答案為:![]() ;
;
(2)由圖可知,A點時反應(yīng)正向進(jìn)行,即![]() ;碘單質(zhì)的轉(zhuǎn)化率為
;碘單質(zhì)的轉(zhuǎn)化率為![]() ,則
,則![]() ,
,![]() ,由
,由![]() 可知
可知![]() ,
,
故答案為:![]() ;
;![]() ;
;
(3)反應(yīng)三段式

則達(dá)到平衡狀態(tài)時,氫氣的物質(zhì)的量分?jǐn)?shù)![]() ;
;
平衡分壓![]() 、
、![]() ,所以
,所以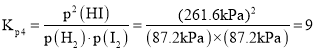 ;
;
由于反應(yīng)![]() ,則
,則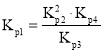 ,則
,則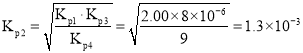 ,
,
故答案為:![]() ;9;
;9;![]() ;
;
(4)A.反應(yīng)達(dá)平衡前,氣體顏色在變,顏色不再變化,則說明反應(yīng)達(dá)平衡,故A正確;
B.由于此反應(yīng)的反應(yīng)物和生成物均為氣體,即體系中氣體的總質(zhì)量不變,而此反應(yīng)前后氣體的物質(zhì)的量也不變,所以氣體的平均相對分子質(zhì)量始終不變,即不能說明反應(yīng)體系達(dá)到平衡狀態(tài),故B錯誤;
C.由于反應(yīng)物均為氣體,且反應(yīng)前后質(zhì)量守恒,且容器為恒容的容器,所以氣體密度始終不變,即氣體密度不變不能說明反應(yīng)是否達(dá)平衡,故C錯誤;
D.化學(xué)變化過程中伴隨著能量的變化,所以溫度不再變化說明反應(yīng)體系達(dá)到平衡狀態(tài),故D正確,
故選:AD;
(5)![]() 是一種強酸,一水合氨是弱堿,常溫下將
是一種強酸,一水合氨是弱堿,常溫下將![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等體積混合后,溶液呈中性即
的氨水等體積混合后,溶液呈中性即![]() ,電荷守恒關(guān)系為
,電荷守恒關(guān)系為![]() ,則
,則![]() ,故以
,故以![]() ,
,
故答案為:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學(xué) 來源: 題型:
【題目】甲、乙兩同學(xué)為探究SO2與可溶性鋇的強酸鹽能否反應(yīng)生成白色BaSO3沉淀,用下圖所示裝置進(jìn)行實驗(夾持裝置和A中加熱裝置已略,氣密性己檢驗)。
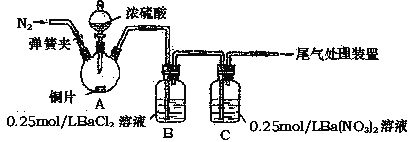
實驗操作和現(xiàn)象:
操作 | 現(xiàn)象 |
關(guān)閉彈簧夾,滴加一定量濃硫酸,加熱 | A中有白霧生成,銅片表面產(chǎn)生氣泡 B中有氣泡冒出,產(chǎn)生大量白色沉淀 C中產(chǎn)生白色沉淀,液面上方略顯淺棕色并逐漸消失 |
打開彈簧夾,通入N2,停止加熱,一段時間后關(guān)閉 | -------------------------------------------------- |
從B、C中分別取少量白色沉淀,加稀鹽酸 | 均未發(fā)現(xiàn)白色沉淀溶解 |
(1)A中反應(yīng)的化學(xué)方程式是__________________________________________。
(2)C中白色沉淀是_________,該沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成淺棕色氣體的化學(xué)方程式是_________________。
(4)分析B中不溶于稀鹽酸的沉淀產(chǎn)生的原因,甲同學(xué)認(rèn)為是空氣參與反應(yīng),乙同學(xué)認(rèn)為是白霧參與反應(yīng)。
①為證實各自的觀點,在原實驗基礎(chǔ)上,甲同學(xué)在原有操作之前增加一步操作,該操作是_____________;乙同學(xué)在A、B間增加洗氣瓶D,D中盛放的試劑是____________。
②甲、乙兩同學(xué)分別改進(jìn)實驗后,B裝置中現(xiàn)象分別為:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
檢驗白色沉淀,發(fā)現(xiàn)均不溶于稀鹽酸。請用離子方程式解釋甲、乙兩同學(xué)改進(jìn)實驗后仍然產(chǎn)生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中兩同學(xué)的方案進(jìn)行實驗。B中無沉淀生成,而C中產(chǎn)生白色沉淀,由此得出的結(jié)論是______________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】鉬![]() 是一種難熔稀有金屬,我國的鉬居世界第二。鉬及其合金在冶金,農(nóng)業(yè)、電器、化工、環(huán)保等方面有著廣泛的應(yīng)用。
是一種難熔稀有金屬,我國的鉬居世界第二。鉬及其合金在冶金,農(nóng)業(yè)、電器、化工、環(huán)保等方面有著廣泛的應(yīng)用。
(1)已知:![]()
![]()
![]() ,則
,則![]() ______
______![]() 用含
用含![]() 、
、![]() 的代數(shù)式表示
的代數(shù)式表示![]()
(2)密閉容器中用![]() 作固硫劑,同時用一定量的氫氣還原輝鉬礦
作固硫劑,同時用一定量的氫氣還原輝鉬礦![]() 的原理是:
的原理是:![]() ,實驗測得平衡時的有關(guān)變化曲線如圖所示:
,實驗測得平衡時的有關(guān)變化曲線如圖所示:
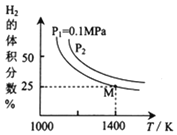
![]() 由圖可知,該反應(yīng)的
由圖可知,該反應(yīng)的![]() ______0
______0![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,
,![]() ______
______![]() MPa
MPa![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 如果上述反應(yīng)在體積不變的密閉容器中達(dá)平衡,下列說法錯誤的是______
如果上述反應(yīng)在體積不變的密閉容器中達(dá)平衡,下列說法錯誤的是______![]() 選填編號
選填編號![]() 。
。
A.![]()
![]() 容器內(nèi)氣體的密度不變時,一定達(dá)平衡狀態(tài)
容器內(nèi)氣體的密度不變時,一定達(dá)平衡狀態(tài)
C.再加入![]() ,則
,則![]() 轉(zhuǎn)化率增大
轉(zhuǎn)化率增大![]() 容器內(nèi)壓強不變時,一定達(dá)平衡狀態(tài)
容器內(nèi)壓強不變時,一定達(dá)平衡狀態(tài)
(3)電氧化法提純鉬的原理:將輝鉬礦![]() 放入裝有食鹽水的電解槽中,用惰性電極電解,
放入裝有食鹽水的電解槽中,用惰性電極電解,![]() 被氧化為
被氧化為![]() 和
和![]() 陰極的電極反應(yīng)式為______。
陰極的電極反應(yīng)式為______。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】在一個盛有催化劑容積可變的密閉容器中,保持一定的溫度和壓強,進(jìn)行以下反應(yīng):N2+3H22NH3。已知加入1molN2和4molH2時,達(dá)到平衡后生成amolNH3.有恒溫恒壓下欲保持平衡時各組分的體積分?jǐn)?shù)不變.填表(恒溫恒壓)
已知 編號 | 起始狀態(tài)物質(zhì)的量/mol | 平衡時NH3的 物質(zhì)的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】常溫下,二氯化二硫(S2Cl2)為橙黃色液體,遇水易水解,工業(yè)上用于橡膠的硫化。某學(xué)習(xí)小組用氯氣和硫單質(zhì)合成S2Cl2的實驗裝置如圖所示.下列說法正確的是
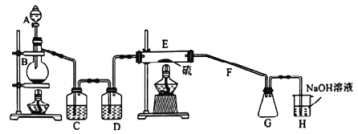
A. 實驗時需先點燃E處的酒精燈
B. C、D中所盛試劑為飽和氯化鈉溶液、濃硫酸
C. 二氯化二硫(S2Cl2)水解反應(yīng)產(chǎn)物為:S、H2S、HCl
D. G中可收集到純凈的產(chǎn)品
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】一定溫度下在一容積不變的密閉容器中發(fā)生可逆反應(yīng)2X(g) ![]() Y(g)+Z(s),以下不能說明該反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的是( )
Y(g)+Z(s),以下不能說明該反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的是( )
A. 混合氣體的密度不再變化 B. 反應(yīng)容器中Y的質(zhì)量分?jǐn)?shù)不變
C. X的分解速率與Y的消耗速率相等 D. 單位時間內(nèi)生成1 mol Y的同時生成2 mol X
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】肼(H2NNH2)是一種高能燃料,有關(guān)化學(xué)反應(yīng)的能量變化如下圖所示。已知斷裂1 mol化學(xué)鍵所需的能量(kJ):N≡N為942、O=O為500、N—N為154,則斷裂1 mol N—H鍵所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】在298 K、1.01×105 Pa,將22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反應(yīng),測得反應(yīng)放出的熱量為a kJ。已知該條件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反應(yīng)放出的熱量為b kJ。則CO2與NaOH反應(yīng)生成NaHCO3的熱化學(xué)方程式為( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】將固體NH4I置于密閉容器中,在一定溫度下發(fā)生下列反應(yīng):
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
達(dá)到平衡時,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,則此溫度下反應(yīng)①的平衡常數(shù)為
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com