
| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
分析 第一份發生的離子反應方程式為Al3++3NH3.H2O=Al(OH)3↓+3NH4+、第二份發生的離子反應方程式為Ba2++SO42-=BaSO4↓,
根據Al3++3NH3.H2O=Al(OH)3↓+3NH4+得n(Al3+)=$\frac{1}{3}$n(NH3.H2O)=$\frac{a}{3}$mol,
則混合溶液中c(Al3+)=$\frac{\frac{a}{3}mol}{\frac{V}{2}L}$=$\frac{2a}{3V}$mol/L;
根據Ba2++SO42-=BaSO4↓得n(Ba2+)=n(SO42-)=bmol,則c(SO42-)=$\frac{bmol}{\frac{V}{2}L}$=$\frac{2b}{V}$mol/L,
任何電解質溶液都呈電中性,根據電荷守恒計算c(Na+).
解答 解:第一份發生的離子反應方程式為Al3++3NH3.H2O=Al(OH)3↓+3NH4+、第二份發生的離子反應方程式為Ba2++SO42-=BaSO4↓,
根據Al3++3NH3.H2O=Al(OH)3↓+3NH4+得n(Al3+)=$\frac{1}{3}$n(NH3.H2O)=$\frac{a}{3}$mol,
則混合溶液中c(Al3+)=$\frac{\frac{a}{3}mol}{\frac{V}{2}L}$=$\frac{2a}{3V}$mol/L;
根據Ba2++SO42-=BaSO4↓得n(Ba2+)=n(SO42-)=bmol,則c(SO42-)=$\frac{bmol}{\frac{V}{2}L}$=$\frac{2b}{V}$mol/L,
任何電解質溶液都呈電中性,根據電荷守恒得c(Na+)=2c(SO42-)-3c(Al3+)=$\frac{4b}{V}$mol/L-$\frac{2a}{V}$mol/L=$\frac{4b-2a}{V}$mol/L,故選A.
點評 本題考查混合物的計算,側重考查分析計算能力,明確各個物理量之間的關系式是解本題關鍵,利用電荷守恒解答即可,注意每份溶液體積不是VL,為易錯題.


科目:高中化學 來源: 題型:解答題
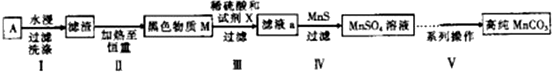
| 實驗編號 | 試劑X | MnSO4/g |
| 1 | 鋅粉 | 2.3595 |
| 2 | 鐵粉 | 2.7184 |
| 3 | 硫化亞鐵 | 2.9911 |
| 4 | 30%過氧化氫 | 3.7349 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 二甲苯一溴代物的熔點/℃ | 234 | 206 | 213 | 204 | 214 | 205 |
| 對應的二甲苯的熔點/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. | 熔點為234℃的是一溴代間二甲苯 | B. | 熔點為234℃的是一溴代鄰二甲苯 | ||
| C. | 熔點為-54℃的是間二甲苯 | D. | 熔點為-27℃的是對二甲苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;Na2O2的電子式:
;Na2O2的電子式: ,H2S的電子式:
,H2S的電子式:
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹵素單質的最外層電子數都是7 | |
| B. | 從上到下,鹵素原子的電子層數依次增多,半徑依次減小 | |
| C. | 鹵素單質與H2化合的容易程度為F2<Cl2<Br2<I2 | |
| D. | 從F到I,原子核對最外層電子的吸引能力依次減弱,原子得電子能力依次減弱,元素的非金屬性依次減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定無Na2CO3,可能有FeCl3 | B. | 一定有MgCl2,一定無NaCl | ||
| C. | 一定有MgCl2,可能有Na2CO3 | D. | 一定有MgCl2,可能有NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com