
| A. | 直徑為20nm的納米碳酸鈣屬于膠體 | |
| B. | 海水中提取鎂的各步均為氧化還原反應 | |
| C. | 可溶性鐵鹽和鋁鹽可用作凈水劑 | |
| D. | 光導纖維是一種新型硅酸鹽材料 |
科目:高中化學 來源: 題型:選擇題
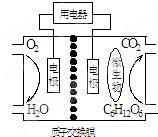
| A. | 該電池能夠在高溫下工作 | |
| B. | 電池的負極反應為:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放電過程中,H+從正極區向負極區遷移 | |
| D. | 在電池反應中,每消耗1mol氧氣,理論上能生成標準狀況下氣體$\frac{2.42}{6}$L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s內O2的反應速率為0.074mol/L•s) | |
| B. | T1℃時平衡常數為0.125,平衡時NO2和O2的轉化率均為50% | |
| C. | T1℃時平衡常數為K1,T2℃時平衡常數為K2,若T1>T2,則K1<K2 | |
| D. | 其它條件不變,將容器的體積的壓縮到原來的一半,則重新達到平衡時c(N2O3)<2mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有兩種同分異構體 | |
| C. | 乙烯可以與氫氣發生加成反應,也可發生自身加聚反應生成聚乙烯 | |
| D. | 纖維素、淀粉和蛋白質都是高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
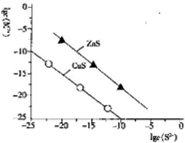
| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃時K甲(CuS)均為1×10-28 | |
| C. | 向l00mLZn2+、Cu2+均為10-5mol•L-1 的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 | |
| D. | 向Cu2+濃度為10-5mol•L-1工業廢水中加入ZnS粉末,會有CuS沉淀析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
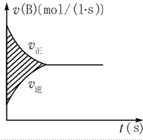
| A. | A濃度的減小量 | B. | B濃度的減小量 | ||
| C. | C物質的量的增加量 | D. | B物質的量的減少量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液中還可能大量存在:H+、NH4+、SO42-、NO3- | |
| B. | AlCl3溶液與過量的氨水反應的離子方程式為:Al3++4NH3•H2O═4NH4++AlO2-+2H2O | |
| C. | 若NA為阿伏伽德羅常數的值,則1L0.1mol•L-1的AlCl3溶液中Al3+的數目為0.1NA | |
| D. | 工業上可用電解熔融的AlCl3來制取金屬Al |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
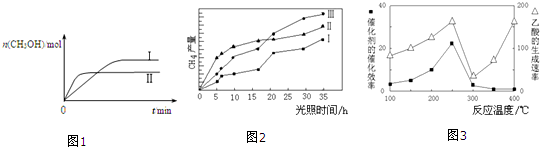
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com