
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
分析 (1)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式,①-②×3得到;
(2)CO-O2燃料電池(以KOH溶液為電解液),依據原電池原理,負極失電子發生氧化反應,燃料在負極失電子發生氧化反應;
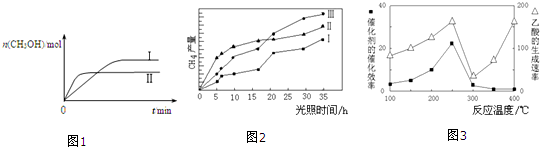
(3)①根據圖象可知,線Ⅱ的反應速率大于線Ⅰ,所以線Ⅱ對應的溫度高于線Ⅰ,而線Ⅱ對應的甲醇的物質的量小,也就是說溫度高反應平衡逆向移動,據此判斷反應的△H,根據溫度對平衡移動的影響可知,升高溫度,平衡向吸熱方向移動,據此判斷平衡常數的變化;
②利用三段式,根據等效平衡的思想可答題設平衡時二氧化碳轉化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
開始1(mol):1 3 0 0
變化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
開始2 a 3a b b;
(4)根據圖象3可知,當溫度300℃~400℃時,線的斜率變化較大,也就是溫度對化學反應速率的影響較大;
②先將Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根據氧化物與酸反應生成離子方程式,需要注意的是一價銅具有還原性.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依據蓋斯定律①-②×3得到熱化學方程式為:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案為:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料電池(以KOH溶液為電解液),一氧化碳在負極失電子發生氧化反應生成二氧化碳在溶液中生成碳酸鉀,原電池負極電極反應為:CO+4OH--2e-=CO32-+2H2O,故答案為:CO+4OH--2e-=CO32-+2H2O;
(3)①根據圖象可知,線Ⅱ的反應速率大于線Ⅰ,所以線Ⅱ對應的溫度高于線Ⅰ,而線Ⅱ對應的甲醇的物質的量小,也就是說溫度高反應平衡逆向移動,據此判斷反應的△H<0,根據溫度對平衡移動的影響可知,升高溫度,平衡向吸熱方向移動,而該反應為放熱反應,所以升高溫度平衡逆向移動,平衡常數變小,即KⅠ>KⅡ,
故答案為:小于;>;
②設平衡時二氧化碳轉化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
開始1(mol):1 3 0 0
變化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
開始2 a 3a b b
則由題意可知:$\frac{x+x+1-x+3-3x}{1+3}$=0.8,解得x=0.4,
根據恒溫恒容條件下的等效平衡的思想則有開始1和開始2為完全等效,即a+b=1,要使反應始終向逆向進行,則b>x,故a的范圍為小于等于1大于0.4,
故答案為:0.4<b≤1;
(4)根據圖象3可知,當溫度大于300℃時,線的斜率變化較大,也就是溫度對化學反應速率的影響較大,故答案為:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,與酸反應生成離子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案為:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
點評 本題主要考查了熱化學方程式的書寫、電極反應的書寫、化學平衡的計算及氧化還原反應方程式的書寫,綜合性較強,有一定的難度.


科目:高中化學 來源: 題型:選擇題
| A. | 直徑為20nm的納米碳酸鈣屬于膠體 | |
| B. | 海水中提取鎂的各步均為氧化還原反應 | |
| C. | 可溶性鐵鹽和鋁鹽可用作凈水劑 | |
| D. | 光導纖維是一種新型硅酸鹽材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中都含有離子鍵 | |
| B. | 離子化合物中的陽離子只能是金屬離子 | |
| C. | 含有共價鍵的化合物不可能是離子化合物 | |
| D. | 溶于水可以導電的化合物一定是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,D的結構式:
,D的結構式: .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和甲烷在一定條件下都可以與氯氣反應 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高錳酸鉀溶液褪色 | |
| D. | 乙烯和乙烷都可以與氫氣發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 、
、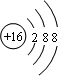 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com